Расплавы
Распла́вы, термин, описывающий вещества в жидком состоянии; пример – жидкие металлы. На диаграмме состояния чистого вещества расплаву соответствует область между линиями затвердевания и испарения, близкая к тройной точке, в которой вещество может одновременно находиться в твёрдом, жидком и газообразном агрегатных состояниях, и относительно далёкая от критической точки, в которой исчезает различие между расплавом и паром. В природе при обычных температурах и атмосферном давлении расплавы (кроме воды и некоторых углеводородов) существуют крайне редко. В глубинных слоях земной коры при высоких температурах и давлениях возможно существование сложных по химическому составу магматических расплавов (магмы), которые при определённых условиях вырываются наружу через вулканические кратеры в виде быстро твердеющей лавы.
Наиболее характерным свойством расплавов, как и всех жидкостей, является текучесть, т. е. способность менять форму при достаточно слабых внешних воздействиях (например, механических сил), что свойственно также газообразному состоянию вещества. Вместе с тем расплавы сохраняют собственный объём даже под действием высоких давлений, в сотни раз превышающих атмосферное, что сильно отличает их от газов, но роднит с твёрдыми веществами.
Практически все расплавы образуются при нагревании твёрдых кристаллических веществ до определённой температуры, называемой температурой плавления (tпл), или при охлаждении газообразных веществ (паров) до температуры кипения (tкип). Аморфные вещества не имеют определённой точки плавления и превращаются в расплавы, постепенно размягчаясь и становясь всё более текучими при повышении температуры (нагревании). Типичными представителями таких веществ являются стёкла и смолы. Аморфные твёрдые вещества часто рассматриваются как переохлаждённые расплавы с очень малой текучестью. Расплавы большинства высокомолекулярных веществ (полимеров) относятся к классу неньютоновских жидкостей, вязкость (свойство, противоположное текучести) которых зависит от скорости сдвига.
Экспериментально найдено, что при заданном давлении количество теплоты, необходимое для превращения одного грамма (или одного моля) твёрдого вещества в жидкое состояние (ΔHпл), гораздо меньше, чем для превращения в пар того же количества расплава (ΔHисп). Например, измеренные при атмосферном давлении ΔHпл и ΔHисп (кДж·моль−1) равны для воды 6,01 и 40,66; для цинка 7,2 и 115,3; для хлорида натрия 28,2 и 138,0; для оксида алюминия 111,4 и 1860,0. Это послужило основанием рассматривать расплавы как «испорченные» кристаллические вещества, в которых при плавлении происходит нарушение периодичности (дальнего порядка) во взаимном расположении составляющих их частиц. В расплавах, как видно на примере хлорида натрия (см. рисунок), упорядоченность в расположении частиц сохраняется лишь на близких расстояниях, соизмеримых с размерами катиона натрия и аниона хлора.
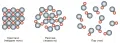 Нарушение периодичности во взаимном расположении ионов Na⁺ (красные) и Cl⁻ (серые) при плавлении кристалла и испарении расплава хлорида натрия (NaCl).Эта закономерность в расположении соседних частиц называется ближним порядком. Ближний порядок – очень важный элемент большинства теорий жидкого состояния, поскольку позволяет применить представления и подходы, развитые для твёрдых веществ, к описанию взаимодействия частиц в расплавах, вносящего главный вклад в термодинамические свойства (внутреннюю энергию, энергию Гиббса, энергию Гельмгольца) вещества в определённых условиях (термодинамического равновесия). Согласно молекулярно-кинетической теории, при нагревании кристаллического вещества увеличивается энергия (амплитуда) колебаний частиц, что приводит к постепенному разрушению кристалла за счёт появления различных дефектов кристаллической решётки (вакансий, взаимного положения атомов, нарушения ориентации осей несферических ионов и др.), критическая концентрация которых достигается в точке плавления. При этой температуре кристаллическая решётка полностью разрушается, распадаясь на относительно слабо связанные между собой и неупорядоченно расположенные относительно друг друга субмикроскопические области, в которых сохраняется ближний порядок во взаимном расположении составляющих их частиц. Расплавление твёрдого вещества, сопровождающееся потерей дальнего порядка и ослаблением связи между частицами, проявляется в существенном увеличении их подвижности, количественной мерой которой могут служить определяемые экспериментально коэффициенты диффузии. Они различаются у твёрдого и расплавленного вещества на несколько порядков их величины. Например, коэффициент диффузии твёрдого серебра в точке плавления равен 2,8·10−13 м2·с−1, жидкого – 2,6·10−9 м2·с−1. В то же время значения теплоёмкости и теплопроводности расплавов, в меньшей степени связанные с потерей дальнего порядка и определяемые в основном обменом энергией между соседними частицами, колеблющимися около временного положения равновесия, не столь существенно отличаются от их значений для твёрдых веществ. Например, измеренные значения теплоёмкости (Дж·моль−1·К−1) и теплопроводности (Дж·м−1·с−1·К−1) равны для льда 36,7 и 2,21; для воды 75,8 и 0,56; для твёрдого хлорида натрия 67,7 и 0,90; для жидкого хлорида натрия 67,9 и 0,71; для твёрдой серы 25,3 и 0,19; для жидкой серы 32,0 и 0,13.
Нарушение периодичности во взаимном расположении ионов Na⁺ (красные) и Cl⁻ (серые) при плавлении кристалла и испарении расплава хлорида натрия (NaCl).Эта закономерность в расположении соседних частиц называется ближним порядком. Ближний порядок – очень важный элемент большинства теорий жидкого состояния, поскольку позволяет применить представления и подходы, развитые для твёрдых веществ, к описанию взаимодействия частиц в расплавах, вносящего главный вклад в термодинамические свойства (внутреннюю энергию, энергию Гиббса, энергию Гельмгольца) вещества в определённых условиях (термодинамического равновесия). Согласно молекулярно-кинетической теории, при нагревании кристаллического вещества увеличивается энергия (амплитуда) колебаний частиц, что приводит к постепенному разрушению кристалла за счёт появления различных дефектов кристаллической решётки (вакансий, взаимного положения атомов, нарушения ориентации осей несферических ионов и др.), критическая концентрация которых достигается в точке плавления. При этой температуре кристаллическая решётка полностью разрушается, распадаясь на относительно слабо связанные между собой и неупорядоченно расположенные относительно друг друга субмикроскопические области, в которых сохраняется ближний порядок во взаимном расположении составляющих их частиц. Расплавление твёрдого вещества, сопровождающееся потерей дальнего порядка и ослаблением связи между частицами, проявляется в существенном увеличении их подвижности, количественной мерой которой могут служить определяемые экспериментально коэффициенты диффузии. Они различаются у твёрдого и расплавленного вещества на несколько порядков их величины. Например, коэффициент диффузии твёрдого серебра в точке плавления равен 2,8·10−13 м2·с−1, жидкого – 2,6·10−9 м2·с−1. В то же время значения теплоёмкости и теплопроводности расплавов, в меньшей степени связанные с потерей дальнего порядка и определяемые в основном обменом энергией между соседними частицами, колеблющимися около временного положения равновесия, не столь существенно отличаются от их значений для твёрдых веществ. Например, измеренные значения теплоёмкости (Дж·моль−1·К−1) и теплопроводности (Дж·м−1·с−1·К−1) равны для льда 36,7 и 2,21; для воды 75,8 и 0,56; для твёрдого хлорида натрия 67,7 и 0,90; для жидкого хлорида натрия 67,9 и 0,71; для твёрдой серы 25,3 и 0,19; для жидкой серы 32,0 и 0,13.
Свойства расплавов различных веществ зависят от типа химической связи между составляющими их частицами (атомами, ионами, молекулами). В большинстве случаев взаимодействие между частицами расплавленного вещества нельзя описать каким-либо одним из известных типов химической связи: ковалентной, ионной, металлической, водородной, ван-дер-ваальсовой. Однако можно выделить несколько основных видов расплавов с преобладающим вкладом в их внутреннюю энергию химической связи определённого типа. Среди них – металлические, ионные, полупроводниковые и молекулярные расплавы, структура, физические и химические свойства которых заметно различаются. В расплавленных металлах валентные электроны слабо связаны с ядрами, легко переходят от одного атома к другому, образуя систему частиц, состоящую из положительно заряженных ионов металла (катионов) и распределённых между ними относительно свободных электронов, уподобляемых «электронному газу» или «электронному облаку». Благодаря этому многие свойства металлических расплавов (например, электро- и теплопроводность) имеют очень высокие значения, не свойственные расплавам других веществ. Большим разнообразием отличается группа ионных расплавов (расплавленные электролиты), которые состоят из положительно и отрицательно заряженных частиц – катионов и анионов, связанных между собой дальнодействующими кулоновскими силами. В неё входят расплавленные соли, оксиды, стеклообразующие силикатные расплавы, а также привлёкшие к себе в последние десятилетия большое внимание ионные жидкости – вещества, плавящиеся при низких температурах, близких к комнатной, катионы и/или анионы которых являются чаще всего фрагментами органических соединений. В полупроводниках при плавлении часть ковалентных связей между атомами может разрываться, что приводит к появлению свойств, присущих жидким металлам и ионным расплавам. Для расплавленных органических, в том числе высокомолекулярных, соединений характерны ковалентные и водородные внутримолекулярные связи и довольно слабые межмолекулярные ван-дер-ваальсовы силы притяжения, что проявляется в термической неустойчивости расплавов этих веществ.
На практике обычно имеют дело с расплавленными смесями веществ, часто содержащими соединения разной химической природы. Свойства многокомпонентных расплавов могут существенно отличаться от свойств составляющих их веществ, что является следствием взаимодействия компонентов расплавленных смесей, приводящего к появлению новых видов структурных частиц (сольватов, комплексных ионов, молекул полимеров, кластеров и др.), в том числе с другим типом химической связи. Например, температура плавления сплава Вуда, состоящего из висмута (tпл 271,4 °C), свинца (tпл 327,5 °C), олова (tпл 231,9 °C) и кадмия (tпл 321,1 °C) равна 68,5 °C, а эвтектическая смесь фторидов лития (tпл 849,0 °C), натрия (tпл 996,0 °C) и калия (tпл 857,0 °C) плавится при 454,0 °C.
Для изучения структуры и свойств расплавов используют самые современные методы исследования, включая рассеяние рентгеновских лучей и нейтронов, электронную и колебательную спектроскопию, ядерный магнитный и электронный парамагнитный резонансы, рефрактометрию, электронную микроскопию, термодинамическую, термохимическую и электрохимическую диагностику, денситометрию, вискозиметрию, кондуктометрию и др. Благодаря быстрому развитию вычислительной техники особое значение для предсказания структурных особенностей и свойств расплавленных веществ приобретают статистические и квантово-механические расчёты, а также различные виды компьютерного моделирования, в том числе методы Монте-Карло и молекулярной динамики.
Расплавы играют большую роль в жизни человека. Металлы, составляющие основу наиболее важных конструкционных материалов (железо, медь, никель), получают в расплавленном состоянии при высокотемпературном восстановлении оксидных или сульфидных руд, а алюминий – электролитическим разложением его оксида, растворённого в расплаве фтористых солей. Из солевых и оксидных расплавов выращивают монокристаллы для современных оптических и электронных приборов. Расплавы являются перспективными теплоносителями и теплоаккумуляторами для энергетических устройств нового поколения, средами для пирохимической переработки природного и техногенного сырья, включая отработавшее ядерное топливо. Производство стекла и изделий из него целиком базируется на силикатных, фторидных и оксидных расплавах. Солевые расплавы – эффективные среды для термической и термохимической обработки металлов и сплавов. Расплавы являются реакционными средами и катализаторами в органическом синтезе.
