Пироны
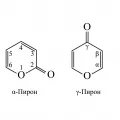
Пиро́ны (кетопираны, оксопираны, пираноны), гетероциклические соединения, оксопроизводные пиранов. Известны два изомера – α-пирон (2H-пирон, 2H-пиранон-2, кумалин) и γ-пирон (4H-пирон, 4H-пиранон-4, пирокоман). Производные пиронов широко распространены в природе: в бобах тонка содержится кумарин, в опии – меконовая кислота, в соке чистотела – хелидоновая кислота; некоторые пигменты растений являются производными γ-пирона. Пироны – структурные фрагменты ряда алкалоидов (например, янгонина, каваина и др.), стероидов, стимулирующих сердечную деятельность (например, сцилларена А, буфатолина), флавоноидов и др. Молярная масса 96,08 г/моль; плотность 1,2000 г/см3 (α-пирон) и 1,1900 г/см3 (γ-пирон при 40,3 °C); tпл 8,5 и 32,5 °C для α- и γ-пирона соответственно; tкип 207,5 и 212,5 °C для α- и γ-пирона соответственно.
Физико-химические свойства
α-Пирон – бесцветная жидкость с запахом свежего сена, растворимая в ацетоне; в любых соотношениях смешивается с водой; при хранении медленно полимеризуется. γ-Пирон – бесцветное кристаллическое вещество, хорошо растворимое в воде, диэтиловом эфире, хлороформе, растворимое в этаноле, бензоле, малорастворимое в сероуглероде.
γ-Пирон – слабое основание; при протонировании по карбонильному атому кислорода он образует кристаллические 4-гидроксипириливые соли. α-Пирон – значительно более слабое основание, протонирование карбонильного атома кислорода происходит только при действии сильных кислот, образующиеся соли выделить не удаётся. Для метилирования карбонильного атома кислорода α-пирона необходимо использовать сильный метилирующий агент тетрафторборат триметилоксония, γ-пирон метилируется при взаимодействии с диметилсульфатом.
Электрофильное замещение (нитрование, сульфирование, галогенирование) в пиронах проходит по положениям 3 и 5.
α-Пирон обладает свойствами непредельных δ-лактонов и легко гидролизуется водными растворами щелочей. γ-Пироны тоже склонны к раскрытию цикла под действием щелочей.
Реакции нуклеофильных агентов с α-пироном могут проходить как по карбонильной группе (реактивы Гриньяра), так и по положениям 4 и 6 (аммиак и амины, цианид-анион). У γ-пирона с реактивами Гриньяра также взаимодействует карбонильная группа.
При действии аммиака и первичных алифатических и ароматических аминов пироны превращаются в пиридоны. Гидрирование α-пирона приводит к образованию насыщенного δ-лактона (тетрагидро-2-пиранона), γ-пирона – продукта полного восстановления (тетрагидропиранола).
α-Пирон участвует в реакции Дильса – Альдера, изомеризуется при облучении ультрафиолетовым светом.
Способы получения
Пироны получают декарбоксилированием в присутствии меди их производных – пиронкарбоновых кислот (соответственно кумалиновой и хелидоновой). α-Пирон можно получить при алкилировании бутен-3-овой кислоты в условиях реакции Принса и последующей циклизации.
Применение
α-Пирон и его производные используются в органическом синтезе как компоненты реакций циклоприсоединения.