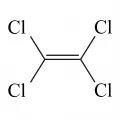
Перхлорэтилен
Перхлорэтиле́н (тетрахлорэтен, тетрахлорэтилен, этилентетрахлорид), органическое вещество; бесцветная прозрачная жидкость с резким запахом. Хлорпроизводное углеводородов С2 общей формулы C2Cl4. Структурная формула CCl2=CCl2. Наряду с тетрахлорметаном (CCl4), гексахлорэтаном (C2Cl6), гексахлорбутадиеном (C4Cl6) относится к категории перхлоруглеродов – органических соединений, в которых водород полностью замещён хлором. Один из продуктов комплексной переработки минерального (поваренная соль) и органического сырья.
Историческая справка
Тетрахлорэтилен впервые получен в 1820 г. М. Фарадеем путём термического разложения гексахлорэтана. А. В. Реньо в 1840 г. получил перхлорэтилен высокотемпературным дехлорированием тетрахлорметана, а также восстановлением гексахлорэтана в спиртовом растворе гидросульфида калия. В. Мейер в 1894 г. получил перхлорэтилен как побочный продукт производства тетрахлорметана сероуглеродным методом. В промышленных условиях малотоннажное производство перхлорэтилена было впервые создано в Германии в 1914 г., но вскоре его выпуск был прекращён. В 1930–1940-х гг. производства перхлорэтилена были созданы в США и Великобритании, причём технологии предусматривали его получение совместно с трихлорэтиленом.
Физические свойства
Бесцветная прозрачная жидкость с резким запахом. Молярная масса 165,83 г/моль; tкип 121,2 °С; tпл –22,7 °С. Плотность перхлорэтилена при разных температурах представлена в таблице 1.
Таблица 1. Плотность перхлорэтилена
Т, °С | –20 | 20 | 60 | 100 |
ρ, кг/м3 | 1688 | 1625 | 1551 | 1484 |
Относительная плотность пара по воздуху равна 5,72; температурный коэффициент объёмного расширения β 0,00108 °С–1 ( в интервале 15–99 °С); теплота сгорания 679,90 кДж/моль; теплота плавления 93,79 кДж/кг; теплота испарения 241,8 кДж/кг (при 20 °С); стандартная теплота образования (г) –15,06 кДж/моль (–3,6 ккал/моль); стандартная теплота образования (ж) –50,6 кДж/моль (–12,1 ккал/моль); энтропия вещества в стандартном состоянии 341 Дж/(моль·К); дипольный момент в бензоле при 20 °С равен нулю. Параметры критического состояния: критическое давление 4,49 МПа; критическая температура 340 °С; критическая плотность 573 кг/м3.
Давление паров при 20 °С 1,86 кПа, при 100 °С 53,32 кПа, при 140 °С 0,165 МПа, при 180 °С 0,862 МПа. Теплоёмкость жидкости при 20 °С 0,858 кДж/(кг·К), теплоёмкость пара при 200 °С 0,648 кДж/(кг·К). Растворимость в воде при 25 °С 0,04 %, растворимость воды в перхлорэтилене 0,008 %. Растворимость хлороводорода в перхлорэтилене при 20 °С 0,535 %.
Перхлорэтилен образует с рядом соединений азеотропные смеси. Состав и температуры кипения азеотропных смесей перхлорэтилена представлены в таблице 2.
Таблица 2. Состав и температуры кипения азеотропных смесей перхлорэтилена
Второй компонент | Массовая доля второго компонента | tкип азеотропной смеси при 101,3 кПа, °С |
15,8 | 87,7 | |
63,5 | 63,8 | |
63,0 | 76,8 | |
Пропанол-1 | 48,0 | 94,1 |
Пропанол-2 | 70,0 | 81,7 |
Бутанол-1 | 29,0 | 109,0 |
Бутанол-2 | 40,0 | 103,1 |
6,0 | 119,1 | |
50,0 | 88,2 | |
38,5 | 107,4 | |
8,5 | 119,2 | |
Изомасляная кислота | 3,0 | 120,5 |
2,6 | 120,5 | |
19,5 | 113,4 | |
1,1,2-Трихлорэтан | 43,0 | 112,0 |
1-Хлор-2,3-эпоксипропан (эпихлоргидрин) | 51,5 | 110,1 |
Химические свойства
Перхлорэтилен является самым устойчивым соединением из всех хлорпроизводных этана и этилена. Он устойчив к гидролизу и менее коррозионноактивен по сравнению с другими алифатическими хлорпроизводными.
1. Окисление.
Окисление перхлорэтилена кислородом воздуха ведёт к образованию трихлорацетилхлорида и фосгена; процесс протекает под действием УФ-излучения:
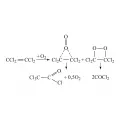 Реакция окисления перхлорэтилена кислородом воздуха.Этот процесс может быть замедлен при использовании аминов и фенолов в качестве стабилизаторов (обычно применяют N-метилпирролидон и N-метилморфолин). Процесс может быть использован для производства трихлорацетилхлорида.
Реакция окисления перхлорэтилена кислородом воздуха.Этот процесс может быть замедлен при использовании аминов и фенолов в качестве стабилизаторов (обычно применяют N-метилпирролидон и N-метилморфолин). Процесс может быть использован для производства трихлорацетилхлорида.
2. Хлорирование.
При реакции тетрахлорэтилена с хлором в жидкой фазе в присутствии небольшого количества FeCl3 (0,1 %) в качестве катализатора при 50–80 °С образуется гексахлорэтан:
3. Взаимодействие с хлором и фтористым водородом.
В присутствии катализатора (пятихлористой сурьмы) при взаимодействии перхлорэтилена с хлором и фтористым водородом получают хладон-113:4. Гидролиз.
При нагревании в кислой среде (лучше всего с серной кислотой) перхлорэтилен гидролизуется до трихлоруксусной кислоты:5. Восстановление.
Перхлорэтилен может быть частично или полностью восстановлен в газовой фазе в присутствии таких катализаторов, как никель, палладий, платина и др.:
Методы синтеза перхлорэтилена
1. Дегидрохлорирование пентахлорэтана в газовой фазе либо в жидкой фазе путём обработки его водными растворами щёлочи:
2. Окислительное дегидрирование 1,1,2,2-тетрахлорэтана:
3. Взаимодействие гексахлорэтана с ацетиленом:
4. Высокотемпературное хлорирование любого углеводорода С1–С3, их хлорпроизводных или их смеси в объёме или на катализаторе (одновременно получается тетрахлорметан либо трихлорэтилен):
Промышленные методы производства перхлорэтилена
Существует несколько промышленных технологий производства перхлорэтилена. Первый метод, имевший важное промышленное значение в 1930–1960-х гг., заключается в получении перхлорэтилена из ацетиленового сырья через промежуточное образование 1,1,2,2-тетрахлорэтана и трихлорэтилена по следующим реакциям:
1,1,2,2-Тетрахлорэтан получают путём жидкофазного хлорирования ацетилена на катализаторе при 90–120 °С. Трихлорэтилен получают отщеплением хлороводорода от 1,1,2,2-тетрахлорэтана в паровой фазе при 400–450 °С (термический процесс) либо при 250–300 °С (каталитический процесс). Возможно также проведение процесса в жидкой фазе омылением с помощью щелочных агентов при 100 °С. Хлорирование трихлорэтилена в жидкой фазе при температуре 70–110 °С в присутствии FeCl3 даёт пентахлорэтан, который затем подвергают жидкофазному дегидрохлорированию (80–120 °С) или каталитическому (активированный уголь) крекингу (при 170–330 °С). В 1970-х гг. метод потерял практическое значение.
Современная технология получения перхлорэтилена
Современная технология получения перхлорэтилена (совместно с тетрахлорметаном) заключается в использовании метода исчерпывающего хлорирования углеводородов С1–С3 или их хлорпроизводных. Метод не требует использования чистого сырья и позволяет использовать отходы производства. Процесс состоит из следующих основных стадий: хлорирование, закалка и конденсация продуктов реакции, абсорбция хлороводорода и очистка соляной кислоты, выделение товарного перхлорэтилена.
Хлорирование ведут в полом футерованном реакторе при 560–580 °С и небольшом избыточном давлении. При хлорировании поддерживается избыток хлора в отходящих газах до 10–15 %. Тепло реакции снимают рециркуляцией жидких продуктов процесса (тетрахлорметан и перхлорэтилен). Далее реакционные газы поступают в закалочную колонну, в которой происходит резкое охлаждение продуктов процесса до 140–150 °С. В этой колонне происходит грубое фракционирование легко- и высококипящих продуктов, включая целевой перхлорэтилен. Далее продукты поступают в систему ректификации, где выделяются товарный перхлорэтилен, а также тетрахлорметан, возвращаемый в реактор в виде рецикла. В системе абсорбции получают товарную соляную кислоту. Количество хлорорганических отходов составляет 100–120 кг на 1 т продукта.
Распространённым вариантом реализации технологии производства перхлорэтилена является оксихлорирование хлорированных углеводородов С2–С3. Хлорорганические соединения, кислород и хлороводород реагируют в присутствии хлормеднокалиевого катализатора на носителе при 420–460 °С. Целевыми продуктами являются трихлорэтилен и перхлорэтилен. Побочными продуктами, наряду с хлорорганическими соединениями, являются оксиды углерода. Продукты разделяются и очищаются на узлах закалки, ректификации и абсорбции. Выход продуктов можно регулировать соотношением реагентов.
Объём мирового производства перхлорэтилена 600–700 тыс. т в год (2023).
Применение
Перхлорэтилен применяется в качестве инертного растворителя, который способен растворять значительное количество веществ органического происхождения (до 60 % производимого перхлорэтилена используется для сухой чистки одежды в химчистках); универсального средства для обезжиривания металлических поверхностей в машиностроении, приборостроении, в текстильной промышленности (например, при выделке кожи и меха), в деревообрабатывающем производстве; как полупродукт для производства хладона-113; как универсальный растворитель при проведении обработки фотополимерных печатных плат, а также при производстве игл к одноразовым шприцам в медицинской промышленности; в качестве интермедиата при проведении реакции получения трихлоруксусной кислоты;
Пожароопасные и токсические свойства
Перхлорэтилен не горюч, не самовоспламеняется, не взрывоопасен. Оказывает токсическое действие на центральную нервную систему и печень, обладает наркотическим эффектом. Предельно допустимая концентрация паров в воздухе рабочей зоны производственных помещений составляет 10 мг/м3.