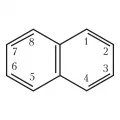
Нафталин
Нафтали́н (от греч. νάφθα – нефть) (бицикло-[4.4.0]-дека-1,3,5,7,9-пентаен; гексален; антимит, нафтален), конденсированный ароматический углеводород, С₁₀Н₈. Нафталин содержится в каменноугольной смоле (до 10 % по массе) и нефти (до 6–7 %). Нафталин токсичен (обладает обще- и гемотоксическим действием, вызывает экземы, дерматиты, помутнение роговицы). Молярная масса 128,17 г/моль; плотность 1,0253 г/см3, 1,14 г/см3 (при 15,5 °C), 0,9625 г/см3 (при 100 °C); tпл 80,3 °C; tкип 218 °C.
История открытия
В 1819 г. нафталин обнаружен в каменноугольной смоле английским учёным У. Т. Брандом. Название предложил в 1821 г. году английский химик и геолог Дж. Кидд, изучавший свойства нафталина. В 1826 г. английский физик и химик М. Фарадей установил эмпирическую формулу нафталина (C5H4)n, в 1866 г. немецкий химик Э. Эрленмейер предложил структуру из двух конденсированных бензольных колец. Формула была подтверждена немецким химиком К. Гребе в 1869 г.
Физико-химические свойства
Нафталин – бесцветное кристаллическое вещество с резким запахом, растворимое в этаноле [9,5 г/100 мл (19,5 °C)], бензоле [40,21 г/100 мл (15,6 °C)], хорошо растворимое в диэтиловом эфире, хлороформе, четырёххлористом углероде, плохо растворимое в воде (0,003 г/100 мл). Перегоняется с водяным паром. Летуч, возгоняется при 50 °C.
Для нафталина наиболее характерны реакции электрофильного замещения: галогенирование, нитрование, сульфирование, алкилирование, ацилирование. Монозамещённые нафталины существуют в двух изомерных формах: α-нафталин (заместитель в одном из четырёх равноценных положений 1, 4, 5, 8; эти положения более активны при электрофильном замещении) и β-нафталин (заместитель в одном из положений 2, 3, 6, 7). В зависимости от условий – природы реагента, катализатора, растворителя, температуры и других факторов – могут быть получены разнообразные по строению ди-, три- и полизамещённые нафталины (например, нафталинсульфокислоты, нитронафталины). Хлорированием при температуре до 150 °C получают перхлорнафталины (C10Cl8). Нафталин гидрируется и окисляется значительно легче, чем бензол. Восстановлением нафталина получают дигидронафталины, 1,2,3,4-тетрагидронафталин (тeтралин) и декагидронафталин (декалин), окислением – 1,4-нафтохинон, фталевый ангидрид и фталевую кислоту.
Способы получения
В промышленности нафталин выделяют кристаллизацией из нафталиновой фракции каменноугольной смолы (tкип 210–220 °C, т. н. нафталиновое масло) или из продуктов переработки нефти.
Применение
Нафталин применяется в производстве фталевого ангидрида, декалина, тетралина, нафтолов, нафтиламинов, нитронафталинов, азокрасителей, пластификаторов, поверхностно-активных веществ, лекарственных средств и др. Применение нафталина в бытовой химии в качестве инсектицида (для борьбы с молью) ограничено, поскольку нафталин относится к условным канцерогенным веществам.
Мировое производство нафталина в 2023 г. составило 2250 тыс. т, к 2032 г. ожидается рост до 3050 тыс. т (Naphthalene Market Analysis ...).