Фталевый ангидрид
Фта́левый ангидри́д (ангидрид 1,2-бензолдикарбоновой кислоты, 1,3-изобензофурандион), ангидрид фталевой кислоты, молярная масса 148,12 г/моль.
Физико-химические свойства
Представляет собой бесцветные орторомбические кристаллы (параметры решётки а = 0,790 нм, b = 1,416 нм, с = 0,594 нм); легко возгоняется, tпл 130,85 °С, tкип 294,5 °С; плотность 1,527 г/см3 (20 °С); теплоёмкость кДж/(кг·К): 1,00 (0 °С), 1,07 (20 °С), 1,70 (150 °С); вязкость (Па·с) 1,19 (133 °С), 0,55 (220 °С); поверхностное натяжение 0,0355 Н/м (155 °С), 0,0327 Н/м (180 °С); давление пара в мм рт. ст.: 0,0018 (35 °С), 0,11 (50 °С), 0,712 (100 °С), 5,88 (130 °С); энтальпия образования −460,02 кДж/моль, энтальпия плавления 22,93 кДж/моль, энтальпия сгорания −3259 кДж/моль; энтропия 1,79 кДж/(моль·°С). Растворимость (в г на 100 г растворителя): в муравьиной кислоте 4,7 (20 °С), тетрахлорметане 0,7 (20 °С), сероуглероде 0,7 (20 °С), пиридине 80 (25 °С), воде 0,62 (25 °С), 19,0 (100 °С), 95,0 (135 °С; с образованием фталевой кислоты); плохо растворяется в этаноле и диэтиловом эфире.
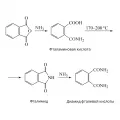 Реакция фталевого ангидрида с аммиаком и первичными аминами, с образованием фталаминовой кислоты, фталимида или диамида фталевой кислоты.Обладает свойствами ароматических соединений. При нагревании с моноатомными спиртами в присутствии серной кислоты H2SO4 (130–140 °С) или органических солей титана (200 °С) образует соответствующие сложные моно- и диэфиры, с многоатомными спиртами в присутствии высоких кислот – полиэфиры. Например, на основе фталевого ангидрида и диолов (этилен-, диэтиленгликоля, пропиленгликоля) получают полиэфиры; на основе фталевого ангидрида и глицерина – алкидные (глифталевые) смолы.
Реакция фталевого ангидрида с аммиаком и первичными аминами, с образованием фталаминовой кислоты, фталимида или диамида фталевой кислоты.Обладает свойствами ароматических соединений. При нагревании с моноатомными спиртами в присутствии серной кислоты H2SO4 (130–140 °С) или органических солей титана (200 °С) образует соответствующие сложные моно- и диэфиры, с многоатомными спиртами в присутствии высоких кислот – полиэфиры. Например, на основе фталевого ангидрида и диолов (этилен-, диэтиленгликоля, пропиленгликоля) получают полиэфиры; на основе фталевого ангидрида и глицерина – алкидные (глифталевые) смолы.
Хлорирование фталевого ангидрида приводит к образованию ангидрида тетрахлорфталевой кислоты, из которого получают самозатухающие полиэфирные смолы. С хлоридом фосфора PCl5 образует фталоилдихлорид C6H4(COCl)2. При нитровании фталевый ангидрид даёт смесь 3- и 4-нитрофталевых кислот, при сульфировании – смесь 3- и 4-сульфопроизводных. С аммиаком NH3 и первичными аминами в зависимости от условий реакции фталевый ангидрид образует фталаминовую кислоту, фталимид или диамид фталевой кислоты:
При пропускании паров фталевого ангидрида и NH3 при 350–400 °С над оксидами алюминия, ванадия, вольфрама, хрома или марганца получается фталодинитрил.
Конденсация фталевого ангидрида с бензолом в присутствии хлорида алюминия AlCl3 и H2SO4 приводит к образованию антрахинона:
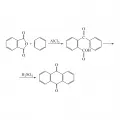 Образование антрахинона при конденсации фталевого ангидрида с бензолом в присутствии AlCl₃ и H2SO₄.Фталевый ангидрид легко реагирует с фенолами и их производными. Так, реакция с фенолом в присутствии H2SO4 и хлорида олова SnCl2 приводит к образованию фенолфталеина, с м-(этиламино)фенолом – родамина, с резорцином – флуоресцеина, с n-хлорфенолом – хинизарина. С мочевиной и солями меди фталевый ангидрид образует нерастворимые пигменты фталоцианины, применяемые в качестве красителей. Декарбоксилирование фталевого ангидрида при 200 °С в присутствии оксида алюминия Al2O3, оксида цинка ZnO приводит к образованию бензойной кислоты; это один из промышленных способов её получения.
Образование антрахинона при конденсации фталевого ангидрида с бензолом в присутствии AlCl₃ и H2SO₄.Фталевый ангидрид легко реагирует с фенолами и их производными. Так, реакция с фенолом в присутствии H2SO4 и хлорида олова SnCl2 приводит к образованию фенолфталеина, с м-(этиламино)фенолом – родамина, с резорцином – флуоресцеина, с n-хлорфенолом – хинизарина. С мочевиной и солями меди фталевый ангидрид образует нерастворимые пигменты фталоцианины, применяемые в качестве красителей. Декарбоксилирование фталевого ангидрида при 200 °С в присутствии оксида алюминия Al2O3, оксида цинка ZnO приводит к образованию бензойной кислоты; это один из промышленных способов её получения.
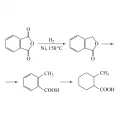
Каталитическое гидрирование фталевого ангидрида на никелевом катализаторе при 150 °С приводит последовательно к образованию фталида, о-толуиловой кислоты, гексагидро-о-толуиловой кислоты; гидрирование при 5 МПа и 300 °С над тем же катализатором – к образованию гексагидрофталевой кислоты:
Фталевый ангидрид при взаимодействии с гидроксидом калия KOH превращается в дикалиевую соль фталевой кислоты, которая при 350–400 °С в присутствии карбоната кальция CaCO3 и Zn изомеризуется в терефталевую кислоту.
Получение
В промышленности фталевый ангидрид получают парофазным каталитическим окислением кислородом воздуха о-ксилола или нафталина с использованием стационарных или псевдоожиженных (нафталин) катализаторов на основе V2O5 ‒ TiO2 или V2O5 ‒ K2SO4. Процесс проводят при 350–400 °С с избытком кислорода воздуха (концентрация углеводорода 40–80 г/м3). Сырой фталевый ангидрид из реакционных газов улавливают в твёрдом виде в аппаратах калориферного типа, очищают и выделяют ректификацией. Выход при окислении о-ксилола 75–80 %, нафталина 85–88 %.
Применение
Фталевый ангидрид применяют в производстве красителей, алкидных смол, пластификаторов, инсектицидов, лекарственных средств, тетрахлорфталевого ангидрида. Фталевый ангидрид – реагент для обнаружения и титриметрического определения низших первичных и вторичных алифатических спиртов, идентификации фенолов и фенольных смол.
Фталевый ангидрид токсичен, вызывает раздражение кожи, слизистых оболочек глаз и носа, способствует заболеванию бронхиальной астмой. Полулетальная доза 4 г/кг (мыши, перорально); предельно допустимая концентрация (ПДК) 1 мг/м3, ПДК (в воде) 0,5 мг/л. Температура вспышки 152 °С, температура воспламенения 165 °С, температура самовоспламенения 580–584 °С; концентрационный предел воспламенения 10,5 % по объёму.