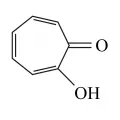
Трополон
Трополо́н (2-гидрокситропон, 2-окси-циклогептатриен-2,4,6-он-1), семичленный циклический оксикетон, ароматическое соединение небензоидного типа, C7H5(OH)O. Цикл трополона представляет собой плоский правильный семиугольник с расстоянием между атомами углерода равным 1,39 Å (как у бензола). Цикл трополона присутствует в структуре многих природных соединений (алкалоиды колхицин, туяплицины и др., стрипитатовая, пуберуловая, пуберулоновая кислоты, пурпурогаллин и др.), обладающих фунгицидным, бактериостатическим, антиоксидантным и антимитотическим действием. Молярная масса 122,12 г/моль; tпл 50–52 °C, tкип 80–84 °C.
Физико-химические свойства
Трополон – бесцветное кристаллическое вещество, растворимое в воде и органических растворителях. Легко возгоняется при комнатной температуре.
Показатель константы кислотности (pKa) составляет 6,92.
Трополон обладает амфотерными свойствами. Со щелочами он образует анионы, в присутствии кислот присоединяет протон. С солями 2- и 3-валентных металлов образует комплексные соединения. С концентрированной соляной или пикриновой кислотами даёт оксониевые соли.
Как фенол трополон участвует в реакциях электрофильного замещения (орто-формилирование, галогенирование, оксиметилирование, азосочетание, аминометилирование, нитрозирование и др.). Карбонильная группа трополона не участвует в характерных для неё реакциях (не образует гидразоны, семикарбазоны и др.). По некоторым свойствам трополон близок к карбоновым кислотам – метиловый эфир трополона проявляет свойства сложных эфиров, 2-аминотрополон ведёт себя как амид.
Трополон с трудом восстанавливается. При окислении в жёстких условиях (перманганат калия, хромовый ангидрид) происходит расщепление цикла. Азотная кислота не окисляет, а нитрирует трополон. При щелочном плавлении кольцо трополона изомеризуется в бензольное с образованием бензойной кислоты. Трополон вступает в реакцию Дильса – Альдера.
Способы получения
Трополон может быть синтезирован из пробковой кислоты; образуется при окислении циклогептатриена-1,3,5 щелочным раствором перманганата калия; при циклизации диэтилового эфира пимелиновой кислоты с последующим бромированием и каталитическим дебромированием; в результате реакции циклоприсоединения между циклопентадиеном и тетрафторэтиленом; при дегидрировании циклогептан-1,2-дионов.