Циклоприсоединение
Циклоприсоедине́ние, соединение друг с другом нескольких молекул с кратными связями с образованием циклического продукта, в котором число кратных связей меньше, чем суммарно их было у реагентов. Примеры – циклодимеризация этилена (рис. 1, а) и взаимодействие бутадиена с этиленом с образованием циклогексена (реакция Дильса – Альдера, или диеновый синтез, рис. 1, б). Известны также внутримолекулярные реакции циклоприсоединения с участием отдельных частей одной молекулы (например, внутримолекулярная реакция Дильса – Альдера на рис. 1, в). Частным случаем циклоприсоединения являются хелетропные реакции, сопровождаемые образованием (разрывом) связей у одного и того же атома (рис. 1, г, д). Процесс, обратный циклоприсоединению, называется циклораспадом, циклоэлиминированием, ретроциклоприсоединением или циклореверсией.
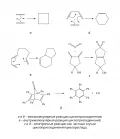 Рис. 1.Для реакций циклоприсоединения рассматривают две пространственно (стереохимически) разных пути: супраповерхностный (s) и антараповерхностный (a) (рис. 2). Если молекулярный фрагмент вовлечён во взаимодействие с одной стороны своей π-системы, говорят о супраповерхностном пути процесса, а если с разных сторон – то об антараповерхностном пути. Такая терминология справедлива не только для π-орбиталей, участвующих во взаимодействии, но и для σ-орбиталей и несвязывающих орбиталей n-типа (ꭃ-орбитали в обозначениях Вудворда и Хофмана).
Рис. 1.Для реакций циклоприсоединения рассматривают две пространственно (стереохимически) разных пути: супраповерхностный (s) и антараповерхностный (a) (рис. 2). Если молекулярный фрагмент вовлечён во взаимодействие с одной стороны своей π-системы, говорят о супраповерхностном пути процесса, а если с разных сторон – то об антараповерхностном пути. Такая терминология справедлива не только для π-орбиталей, участвующих во взаимодействии, но и для σ-орбиталей и несвязывающих орбиталей n-типа (ꭃ-орбитали в обозначениях Вудворда и Хофмана).
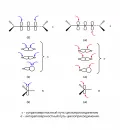 Рис. 2.Существует два способа обозначения реакций циклоприсоединения. При первом способе в круглых скобках указывают число атомов реагентов, участвующих в формировании циклического переходного состояния (m + n + p…). Например, реакцию Дильса – Альдера на рис. 1, б, называют [4 + 2]-циклоприсоединением (по числу атомов углерода бутадиена и этилена), хелетропную реакцию на рис. 1, г, – [4 + 1]-присоединением, а хелетропный процесс на рис. 1, д, – [4 + 1]-элиминированием.
Рис. 2.Существует два способа обозначения реакций циклоприсоединения. При первом способе в круглых скобках указывают число атомов реагентов, участвующих в формировании циклического переходного состояния (m + n + p…). Например, реакцию Дильса – Альдера на рис. 1, б, называют [4 + 2]-циклоприсоединением (по числу атомов углерода бутадиена и этилена), хелетропную реакцию на рис. 1, г, – [4 + 1]-присоединением, а хелетропный процесс на рис. 1, д, – [4 + 1]-элиминированием.
Второй способ обозначений циклоприсоединения более детальный: в квадратных скобках учитывается число электронов каждого реагента, принимающих участие в формировании циклического переходного состояния ([m + n + p…]), тип орбиталей (σ, π или n) и стереохимия взаимодействия реагентов друг с другом (супра/антара). Например, реакцию на рис. 3 можно классифицировать как [π10a + π2s]-циклоприсоединение.
![Пример [π10a+π2s]-циклоприсоединения Пример [π10a+π2s]-циклоприсоединения](https://i.bigenc.ru/resizer/resize?sign=-YXxdC3dG_waFtOUwdVdzg&filename=vault/24d00ca955f1633289c336c2856b1fdb.webp&width=120) Рис. 3. Пример [π10a+π2s]-циклоприсоединения.Различают два принципиально разных вида условий протекания циклоприсоединения: термические (когда процесс индуцируется нагреванием, Δ) и фотохимические (когда циклоприсоединение индуцируется фотооблучением, ).
Рис. 3. Пример [π10a+π2s]-циклоприсоединения.Различают два принципиально разных вида условий протекания циклоприсоединения: термические (когда процесс индуцируется нагреванием, Δ) и фотохимические (когда циклоприсоединение индуцируется фотооблучением, ).
Реакции циклоприсоединения были всесторонне изучены экспериментально и теоретически: методами корреляционных диаграмм орбиталей/состояний (Вудворд, Хофман), граничных орбиталей (Фукуи), топологически (Дьюар, Хейльброннер) и в квантово-химических расчётах. Полученные результаты позволяют говорить о разрешённости или запрещённости того или иного механизма циклоприсоединения в -условиях, причём тот механизм, который разрешён в термических условиях, запрещён в фотохимических, и наоборот.
Для реакций циклоприсоединения механизм (s/a) зависит от общего числа электронов (N), формирующих переходное состояние (n = 0, 1, 2…).
Правила отбора для термических и фотохимических реакций циклоприсоединения
Тип циклоприсоединения | Термическая реакция (Δ) | Фотохимическая реакция () |
s, s/a, a- | N = 4n + 2 | N = 4n |
s, a- | N = 4n | N = 4n + 2 |
Отсюда следует, что [π2s + π2s]-циклоприсоединение (N = 4) может протекать по одностадийному (перициклическому) s, s/a, a-пути только в фотохимических условиях, тогда как в термических условиях реакция «s, s/a, a-» должна идти по постадийному механизму через тетраметиленовый интермедиат бирадикального или биполярного (цвиттер-ионного) типа (рис. 4). Выбор того или иного пути циклоприсоединения зависит от строения реагентов и от условий проведения реакции. Из-за высоконапряжённого четырёхчленного циклического переходного состояния реакции [2 + 2]-циклоприсоединения встречаются довольно редко. Их протеканию, однако, способствует поляризация взаимодействующих молекул, достигаемая либо при введении в них электронодонорных или электроноакцепторных заместителей, либо при переходе от связей С=С к связям С=X, где X – электроотрицательный гетероатом или, например, электроноакцепторная карбонильная группа C=O.
![Термические (Δ) и фотохимический (hv) механизмы [2+2]-циклоприсоединения Термические (Δ) и фотохимический (hv) механизмы [2+2]-циклоприсоединения](https://i.bigenc.ru/resizer/resize?sign=h_lmL9YMT_cWrd165-1qNg&filename=vault/4c35d4bffec2ca465d4a4d5bbd68da4f.webp&width=120) Рис. 4. Термические (Δ) и фотохимический (hv) механизмы [2+2]-циклоприсоединения.Примеры стереоспецифических [π2s + π2a]-циклоприсоединений с участием поляризованных связей С=С приведены на рис. 5. Примеры соответствующих процессов с участием гетерокумуленов состава X=C=Y, где в общем случае X=CRR1, NR2; Y=CRR1, O, S, NR2 – на рис. 6. Причина высокой активности таких систем – в особом строении π-системы, состоящей из двух взаимно ортогональных фрагментов π1 и π2 (рис. 7). Выгодное перекрывание одной p-орбитали π1-связи и одной p-орбитали π2-связи с π-системой кетенофила-алкена [при антара-пространственном расположении реагентов (т. е. наискось)] обеспечивает стабилизацию переходного состояния s, a-циклоприсоединения.
Рис. 4. Термические (Δ) и фотохимический (hv) механизмы [2+2]-циклоприсоединения.Примеры стереоспецифических [π2s + π2a]-циклоприсоединений с участием поляризованных связей С=С приведены на рис. 5. Примеры соответствующих процессов с участием гетерокумуленов состава X=C=Y, где в общем случае X=CRR1, NR2; Y=CRR1, O, S, NR2 – на рис. 6. Причина высокой активности таких систем – в особом строении π-системы, состоящей из двух взаимно ортогональных фрагментов π1 и π2 (рис. 7). Выгодное перекрывание одной p-орбитали π1-связи и одной p-орбитали π2-связи с π-системой кетенофила-алкена [при антара-пространственном расположении реагентов (т. е. наискось)] обеспечивает стабилизацию переходного состояния s, a-циклоприсоединения.
В принципе, перициклическое [2 + 2]-циклоприсоединение кетенов к кетенофилам может протекать через два конкурирующих переходных состояния (рис. 8). В соответствии с обобщённым правилом отбора Вудворда – Хофмана в термических условиях разрешены те перициклические реакции, в которых общее число (4q + 2)-супра- и (4r)-антара-компонент нечётно (q = 0, 1, 2…; r = 1, 2, 3…). Для обоих переходных состояний на рис. 8 правило отбора выполнено: общее число компонент нечётное.
![Перекрывание орбиталей в двух возможных переходных состояниях перициклического [2+2]-циклоприсоединения кетенов к кетенофилам, протекающего в термических условиях Перекрывание орбиталей в двух возможных переходных состояниях перициклического [2+2]-циклоприсоединения кетенов к кетенофилам, протекающего в термических условиях](https://i.bigenc.ru/resizer/resize?sign=t0woSunyxIfaSHAC18qBLw&filename=vault/143665cf8f40d37a7f62877e3bfc1a03.webp&width=120) Рис. 8. Перекрывание орбиталей в двух возможных переходных состояниях перициклического [2+2]-циклоприсоединения кетенов к кетенофилам, протекающего в термических условиях (показано в квадратных скобках).Термические [2 + 2]-циклореверсии также должны протекать либо через бирадикальный интермедиат, либо по s, a-пути, – в отличие от фотохимических условий, где даже незамещённые циклобутаны будут подвергаться согласованному (одностадийному) распаду.
Рис. 8. Перекрывание орбиталей в двух возможных переходных состояниях перициклического [2+2]-циклоприсоединения кетенов к кетенофилам, протекающего в термических условиях (показано в квадратных скобках).Термические [2 + 2]-циклореверсии также должны протекать либо через бирадикальный интермедиат, либо по s, a-пути, – в отличие от фотохимических условий, где даже незамещённые циклобутаны будут подвергаться согласованному (одностадийному) распаду.
В условиях фотооблучения, когда у части реагирующих молекул происходит перенос одного электрона π-связи на вышележащую орбиталь, а у другой части молекул электронные оболочки не меняются, реакции [2 + 2]-циклоприсоединения идут весьма охотно (примеры приведены на рис. 9, а, б). Этот эффект объясняется перекрыванием в фазе граничных молекулярных орбиталей (МО) двух двойных связей (рис. 9, в): высшая занятая молекулярная орбиталь (ВЗМО – однократнозанятая МО) возбуждённой кратной связи C=C* и несвязывающая молекулярная орбиталь (НСМО) невозбуждённой кратной связи С=С.
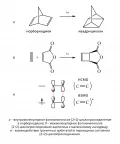 Рис. 9.Такого рода процессы должны протекать в соответствии с правилами отбора, однако чаще всего они следуют через бирадикальные интермедиаты. Фотохимические [2 + 2]-циклоприсоединения успешно используются в синтезах напряжённых и каркасных систем (рис. 10).
Рис. 9.Такого рода процессы должны протекать в соответствии с правилами отбора, однако чаще всего они следуют через бирадикальные интермедиаты. Фотохимические [2 + 2]-циклоприсоединения успешно используются в синтезах напряжённых и каркасных систем (рис. 10).
![Неклассические системы, в синтезах которых использованы реакции фотохимического [2+2]-циклоприсоединения Неклассические системы, в синтезах которых использованы реакции фотохимического [2+2]-циклоприсоединения](https://i.bigenc.ru/resizer/resize?sign=OH7XKFB1h5p0KfAtHsFslA&filename=vault/f51d8e12894bb1d7b14949ca54b2cd77.webp&width=120) Рис. 10. Неклассические системы, в синтезах которых использованы реакции фотохимического [2+2]-циклоприсоединения.Фотохимические [2 + 2]-циклореверсии могут быть как согласованными, так и постадийными процессами. Примеры – фотохимически разрешённые [σ2s + σ2s]-циклораспады с образованием несопряжённого полиолефина (рис. 11, а) или бульвалена (рис. 11, б).
Рис. 10. Неклассические системы, в синтезах которых использованы реакции фотохимического [2+2]-циклоприсоединения.Фотохимические [2 + 2]-циклореверсии могут быть как согласованными, так и постадийными процессами. Примеры – фотохимически разрешённые [σ2s + σ2s]-циклораспады с образованием несопряжённого полиолефина (рис. 11, а) или бульвалена (рис. 11, б).
![Фотохимически разрешённые [σ2s + σ2s]-циклореверсии Фотохимически разрешённые [σ2s + σ2s]-циклореверсии](https://i.bigenc.ru/resizer/resize?sign=F9ivkwHzSaTgW4XRo0pdxg&filename=vault/a4693a7fff7d5b6423b4c000cd89f023.webp&width=120) Рис. 11. Фотохимически разрешённые [σ2s + σ2s]-циклореверсии.Важнейшим случаем [4 + 2]-циклоприсоединения является диеновый синтез, или реакция Дильса – Альдера (рис. 1, б, в), – процесс, как правило, не требующий ни катализаторов, ни фотохимического инициирования. В формировании переходного состояния этой реакции принимают участие 6 π-электронов диена и диенофила, и, таким образом, процесс разрешён в термических условиях.
Рис. 11. Фотохимически разрешённые [σ2s + σ2s]-циклореверсии.Важнейшим случаем [4 + 2]-циклоприсоединения является диеновый синтез, или реакция Дильса – Альдера (рис. 1, б, в), – процесс, как правило, не требующий ни катализаторов, ни фотохимического инициирования. В формировании переходного состояния этой реакции принимают участие 6 π-электронов диена и диенофила, и, таким образом, процесс разрешён в термических условиях.
Изоэлектронными аналогами термического [π4s + π2s]-циклоприсоединения являются реакции [3 + 2]-циклоприсоединения, – высокостереоспецифичные 1,3-диполярные процессы (рис. 12).
 Рис. 12.Для формирования пятичленных гетероциклических фрагментов в решении задач медицинской химии наиболее часто используются такие дипольные системы, как азиды R=N=N=N, диазоалканы R–CH=N=N и нитрилоксиды R–CNO, а в качестве диполярофилов – алкены и алкины. Обычно рассматриваются два конкурирующих механизма [3 + 2]-циклоприсоединения: синхронный механизм Хьюсгена и постадийный механизм Файерстоуна. Помимо 1,3-циклоприсоединения известны также диполярные реакции 1,4-циклоприсоединения.
Рис. 12.Для формирования пятичленных гетероциклических фрагментов в решении задач медицинской химии наиболее часто используются такие дипольные системы, как азиды R=N=N=N, диазоалканы R–CH=N=N и нитрилоксиды R–CNO, а в качестве диполярофилов – алкены и алкины. Обычно рассматриваются два конкурирующих механизма [3 + 2]-циклоприсоединения: синхронный механизм Хьюсгена и постадийный механизм Файерстоуна. Помимо 1,3-циклоприсоединения известны также диполярные реакции 1,4-циклоприсоединения.
В 1936 г. была открыта первая реакция [4 + 4]-циклоприсоединения (Физер, Лотроп, рис. 13, а). Протекающие в соответствии с правилами Вудворда – Хофмана в фотохимических условиях, такие процессы перспективны для синтеза макроциклических природных соединений типа противоракового препарата таксола и фитогормона фузикокцина (рис. 13, б, в).
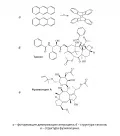 Рис. 13.В условиях фотоиндуцирования восьмичленное циклическое переходное состояние стабилизируется благоприятным (в фазе) взаимодействием занятой одним электроном орбитали (ВЗМО) возбуждённой молекулы бутадиена и вакантной орбитали (НСМО) невозбуждённой молекулы-партнёра (рис. 14).
Рис. 13.В условиях фотоиндуцирования восьмичленное циклическое переходное состояние стабилизируется благоприятным (в фазе) взаимодействием занятой одним электроном орбитали (ВЗМО) возбуждённой молекулы бутадиена и вакантной орбитали (НСМО) невозбуждённой молекулы-партнёра (рис. 14).
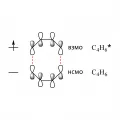 Рис. 14. Орбитальные взаимодействия для фотовозбуждённой (C₄H₆*) и невозбуждённой (C₄H₆) молекул бутадиена-1,3.Реакции [3 + 2]-, [4 + 1]- и [4 + 2]-циклоприсоединения исключительно важны для клик-химии.
Рис. 14. Орбитальные взаимодействия для фотовозбуждённой (C₄H₆*) и невозбуждённой (C₄H₆) молекул бутадиена-1,3.Реакции [3 + 2]-, [4 + 1]- и [4 + 2]-циклоприсоединения исключительно важны для клик-химии.

