Сорбиновая кислота
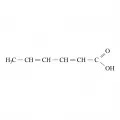
Сорби́новая кислота́ (2,4-гексадиеновая кислота, гександиен-2,4-овая-1-кислота, 2-пропенилакриловая кислота, α,γ-пентадиен-α-карбоновая кислота), одноосновная ненасыщенная алифатическая карбоновая кислота, транс-транс-изомер 2,4-гексадиеновой кислоты, CH3CН=CHCH=CHCOOH. Соли и эфиры сорбиновой кислоты называются сорбатами. Впервые получена А. В. фон Гофманом в 1859 г. из сока неспелой рябины (Sorbus aucuparia). Молярная масса 112,13 г/моль. Плотность 1,204 г/см3. Температура плавления 134,5 °C. Температура кипения 228 °C (с разложением).
Физико-химические свойства
Сорбиновая кислота – бесцветное кристаллическое вещество, малорастворимое в холодной воде [0,15 г/100 мл (25 °C)], растворимое в горячей воде [3,9 г/100 мл (100 °C)], хорошо растворимое в органических растворителях: этаноле [12,63 г/100 мл (25 °C), 62,9 г/100 мл (75 °C)], диэтиловом эфире [6,22 г/100 мл (23 °C)], бензоле [2,34 г/100 мл (25 °C), 24 г/100 мл (75 °C)], ацетоне [9,2 г/100 мл (20 °C)], ледяной уксусной кислоте [12 г/100 мл (20 °C)], четырёххлористом углероде [1,3 г/100 мл (20 °C)]. Сорбиновая кислота легко возгоняется при температуре выше 60 °C.
Константа диссоциации кислоты (pKa) составляет 4,76.
Сорбиновая кислота проявляет химические свойства карбоновых кислот и диеновых углеводородов. Как кислота, она образует соли, сложные эфиры, ангидриды, амиды и др. При восстановлении сорбиновой кислоты алюмогидридом лития карбоксильная группа (–COOH) легко превращается в спиртовую (–OH). Сорбиновая кислота легко окисляется, при этом в зависимости от условий проведения реакции могут образовываться фумаровая, виноградная, уксусная, щавелевая кислоты, уксусный и малоновый альдегиды. Как непредельное соединение, сорбиновая кислота взаимодействует с галогенами и галогеноводородами, гидроксиламином, аммиаком, бисульфитом натрия и др. Сорбиновая кислота гидрируется в присутствии никеля Ренея или палладия уже при комнатной температуре и нормальном давлении с образованием α-гексеновой кислоты с примесью β-гексеновой и капроновой кислот. Медленнее гидрируется двойная связь, смежная с карбоксильной группой.
Сопряжённые двойные связи и карбоксильная группа обусловливают склонность сорбиновой кислоты к диеновому синтезу и полимеризации, а также трудность её декарбоксилирования.
Способы получения
Сорбиновая кислота образуется в реакции конденсации Кнёвенагеля с использованием малоновой кислоты или её солей и кротонового альдегида; тримеризацией уксусного альдегида.
В промышленности сорбиновую кислоту получают конденсацией кетена с кротоновым альдегидом.
Участие в обмене веществ
Сорбиновая кислота проявляет противомикробную активность, особенно активна она против дрожжей и плесневых грибов. Некоторые микроорганизмы выработали механизмы обезвреживания сорбиновой кислоты, такие как декарбоксилирование, образование сложных эфиров, восстановление.
Применение
Сорбиновую кислоту и её соли применяют как консервант пищевых продуктов (пищевые добавки Е200–Е203), в синтезе пластификаторов, смазочных масел, алкидных смол и др.