Атеросклеротические сердечно-сосудистые заболевания
Атеросклероти́ческие серде́чно-сосу́дистые заболева́ния (АССЗ), хронические заболевания, характеризующиеся специфическим поражением артерий, которое приводит к расстройствам кровообращения.
Сердечно-сосудистые заболевания (ССЗ), в том числе атеросклеротические (АССЗ) и их осложнения [нестабильная стенокардия, инфаркт миокарда (ИМ), инсульт], являются основными причинами инвалидизации и смертности в большинстве европейских стран, включая Россию. В основе большинства случаев ССЗ лежит атеросклероз, при котором холестерин и другие липиды, а также клеточные элементы и фибрин накапливаются в стенках артерий, формируя бляшки, и тем самым ограничивают кровоток.
Наиболее распространены такие проявления АССЗ, как ишемическая болезнь сердца (ИБС), ИМ, нарушение мозгового кровообращения (НМК). ИБС является одной из основных причин смерти от сердечно-сосудистых заболеваний в экономически развитых странах.
Патогенез
В настоящее время считают, что в основе развития атеросклеротического процесса в стенке сосуда лежит эндотелиальная дисфункция, связанная с нарушением баланса между гуморальными факторами, оказывающими потенциальное защитное действие (NO, эндотелиальный фактор гиперполяризации, простагландин – PGI), и факторами, повреждающими стенку сосуда (эндотелин-1, тромбоксан А2, супероксид-анион), а также атеросклеротический процесс вызывается эндотоксимией, приводящей к повреждению гликокаликса эндотелия, повышению проницаемости эндотелия для активизированных макрофагов, апоптозу и аноикозу эндотелиоцитов с образованием дефектов в монослое. Одновременно происходит активация иммуновоспалительных процессов в сосудистой стенке под влиянием вторичных стимулирующих сигналов, тесно связанных с факторами риска эндотелиальной дисфункции, которая способствует развитию атеросклероза. Атеросклероз рассматривают как локальное воспаление стенок сосуда, являющееся результатом взаимодействия моноцитов с сосудистыми, эндотелиальными, и гладкомышечными клетками (рисунок «Схематическое изображение этапов развития атеросклеротической бляшки»).
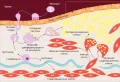 Схематическое изображение этапов развития атеросклеротической бляшки.
Схематическое изображение этапов развития атеросклеротической бляшки.
Воспаление является центральным фактором на всех стадиях атеросклероза. По изученным данным, в основе дальнейшего развития атерогенеза лежит эндотелиальная активация в месте воспаления, с целью задержки проникновения циркулирующих моноцитов. Наиболее ранним клеточным дефектом при атерогенезе является, по мнению исследователей, адгезия моноцитов и их миграция внутрь артериальной стенки (Lesnik. 2003). Прилипание моноцитов к активированным клеткам эндотелия происходит вследствие чрезмерной экспрессии на их поверхности молекул межклеточной адгезии ICAM-1, способствующих миграции активированных моноцитов (CD14+CD16+TLR4+ моноцит) к месту внедрения, молекул адгезии сосудистых клеток (VCAM-1), Е- и Р-селектина, активирующихся, в свою очередь, транскрипционным ядерным фактором (NF)-каппа-В и провоцирующих активное внедрение моноцитов в местах воспаления сосудистой стенки, в том числе и под влиянием VLA-4 (CD49d/CD29, известного под названием «интегрин»), являющегося лейкоцитарным рецептором VCAM-1. VLA-4 экспрессирован на поверхности большинства лейкоцитов, связывается с VCAM-1 и фибронектином. После активации лейкоцита хемокинами, секретируемыми эндотелиальными клетками в очаге повреждения, интегрин меняет конформацию и связывает VCAM-1 с высокой аффинностью, что приводит к адгезии лейкоцитов на повреждённом эндотелии (Rose. 2007). Часть проникших в интиму (внутренний слой артерии или вены) моноцитов под влиянием лейкотреина LTB-4, моноцитарного колониестимулирующего (M-CSF), гранулоцитарно-моноцитарного колониестимулирующего (GM-CSF) и других факторов, секретируемых клетками эндотелия, подвергаются дифференциации и пролиферации, экспрессируют скевенджер-рецепторы и, захватывая модифицированные липопротеины низкой плотности (ЛПНП), превращаются в макрофаги. Макрофаги, захватившие большое количество ЛПНП, в свою очередь, превращаются в жировые, или пенистые, клетки. При участии M-CSF также происходит появление фенотипа макрофагов, не трансформирующихся в пенистые клетки и в дальнейшем секретирующих провоспалительные цитокины [интерлейкин (ИЛ)-1b, фактор некроза опухоли (TNF 1-α)]. Секретируемые ими хемоаттрактанты, например тромбоцитарный фактор роста, активируют гладкомышечные клетки, вызывая их миграцию из медии (средней оболочки артериальных сосудов) в интиму сосуда. Дальнейшие взаимодействия между воспалительными клетками эндотелия, экстрацеллюлярным матриксом и сосудистыми клетками в конечном счёте приводят к формированию атеросклеротического поражения.
Некоторые из недавних результатов исследования атеросклероза на молекулярном уровне подтверждают роль макрофагов и цитокинов (Adenovirus-mediated gene transfer ... 2000). Бесконтрольное накопление холестерина в макрофагах происходит именно в результате распознавания рецепторами макрофага (или скевенджер-рецепторами) – CD36 и SR-A – модифицированных ЛПНП. Недавние исследования показывают, что может происходить поглощение ЛПНП, модифицированных ферментом фосфолипазой A2 (PLA2). Фосфолипаза А2 входит в семейство ферментов, участвующих в гидролизе соединений сложных эфиров жирных кислот, глицерофосфолипидов, в результате которого образуются жирные кислоты и лизофосфолипиды. Секретируемая фосфолипаза A2 (sPLA2) имеет низкую молекулярную массу, что требует каталитической активации с помощью Ca²⁺. В 21 в. у людей обнаружены всего девять изоформ sPLA2 (IB, IIA, IID, IIE, IIF, V, X и XII). Форма V sPLA2 (sPLA2-V) гидролизует фосфатидилхолин, бо́льшая часть которого включена в ЛПНП. Гидролиз ЛПНП с помощью sPLA2 приводит к скоплению частиц ЛПНП на сосудистой стенке. Частицы ЛПНП, модифицируемые секретируемым эндотелием ферментом сфингомиелиназой (С-SMase), также скапливаются на сосудистой стенке, что и приводит к атерогенному накоплению липидов в артериальной стенке и их проникновению в эндотелий. Известно также, что sPLA2-V и сфингомиелиназа были найдены и в атеросклеротических бляшках. Экстрацеллюлярный матрикс также играет важную роль в захвате гидролизованных ЛПНП с помощью sPLA2 (Group V sPLA2 hydrolysis of low-density lipoprotein results ... 2004). Эти результаты заставляют прийти к заключению, что sPLA2 и сфингомиелиназа взаимодействуют с экстрацеллюлярным матриксом, чтобы усилить захват и агрегацию ЛПНП. Также в последнее время доказано участие и изоформы Х sPLA2 в образовании гидролизированных ЛПНП (Potent modification of low density lipoprotein ... 2002). Поглощение пенистыми клетками ЛПНП уменьшает способность этих клеток к миграции, что приводит к дальнейшему их скоплению.
В результате этих процессов происходит постоянное внедрение моноцитарных клеток через эндотелий в сосудистую стенку с превращением их в макрофагальные клетки под влиянием цитокинов и Т-лимфоцитов (а в дальнейшем – при насыщении липидами низкой плотности) и в пенистые (жировые, или ксантомные) клетки, являющиеся основой образования атеросклеротических бляшек. Так же происходит и миграция гладкомышечных клеток под влиянием цитокинов и Т-лимфоцитов с превращением их в жировые клетки. Часть из них под влиянием фактора роста усиливает гипертрофию сосудистой стенки.
Известно также, что после внедрения модифицированного ЛПНП в стенку сосуда «факторы риска» и эндотелиальная дисфункция способствуют трансформированию модифицированного ЛПНП в аутоантиген с запуском аутоиммунной воспалительной реакции. Одновременно под влиянием стресса, бактериального белка теплового шока (HSP60/65), эндотелиальная клетка продуцирует собственные белки теплового шока HSP, стимулирующие иммунную систему для активации синтеза антител к белкам теплового шока Т-хелперами 2 (Th2-клетками), при этом одновременно стимулируя аутоиммунный воспалительный процесс через систему Т-хелперов 1 (Th1-клеток), продуцирующих цитокины (Blasi. 2008).
По мнению исследователей, воспаление и является той неспецифической, но стереотипной и универсальной реакцией эндотелия на повреждение, вызываемой столь разнообразными факторами риска. 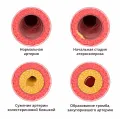 Схематическое изображение развития атеросклеротической бляшки.Такой взгляд на патогенез атеросклероза объединяет популярную теорию «ответа на повреждение» и воспалительную теорию атерогенеза. Воспалению придают особое значение и в процессе дестабилизации атеросклеротической бляшки. Истончение фиброзной покрышки (менее 65 мкм) и увеличение липидного ядра (более 30 % объёма бляшки) считают важными факторами дестабилизации, приводящими к разрыву и развитию тромботических осложнений, в частности ИМ и инсульта.
Схематическое изображение развития атеросклеротической бляшки.Такой взгляд на патогенез атеросклероза объединяет популярную теорию «ответа на повреждение» и воспалительную теорию атерогенеза. Воспалению придают особое значение и в процессе дестабилизации атеросклеротической бляшки. Истончение фиброзной покрышки (менее 65 мкм) и увеличение липидного ядра (более 30 % объёма бляшки) считают важными факторами дестабилизации, приводящими к разрыву и развитию тромботических осложнений, в частности ИМ и инсульта.
История
Атеросклероз остаётся наиболее частой причиной заболеваемости и смертности в развитых странах, в том числе и в России.
В исторической ретроспективе можно отметить определённые вехи в развитии теории патогенеза атеросклероза, начиная с 1829 г., когда Ж. Лобштейн ввёл в практику термин arteriosclerosis (l'artériosclérose). В 1904 г. немецкий патолог Ф. Маршан обозначил термином arteriosclerosis дегенеративный процесс в интиме артерий. В 1908 г. российский учёный А. И. Игнатовский впервые создал экспериментальную холестериновую модель атеросклероза на кролике, находившемся на диете из молока и желтка яиц, а в 1913 г. Н. Н. Аничков и С. С. Халатов воспроизвели эту модель путём добавления чистого холестерина в пищу кролика и впервые доказали холестериновую теорию развития атеросклероза.
В середине 1970-х гг. Р. Росс выдвинул теорию развития атеросклероза как локального воспалительного процесса в эндотелии артерий и в 1999 г. опубликовал программную статью в журнале The New England Journal of Medicine (Ross. 1999), открывшую иммунологическую эру в изучении атеросклероза.
Варианты развития атеросклероза
Атеросклероз – патологический процесс, приводящий к изменению стенки артерий (преимущественно коронарных, брахицефальных артерий и артерий нижних конечностей) в результате накопления липидов, образования фиброзной ткани и формирования бляшки, сужающей просвет сосуда.
К клиническим проявлениям заболевания приводит прогрессия атеросклеротического процесса, вызванного дислипидемией (ДЛП). В зависимости от преимущественно поражённого сосудистого бассейна комплекс симптомов и синдромов широко варьирует.
Основным осложнением атеросклероза коронарных артерий является ИБС, которая клинически проявляется стенокардией, ИМ, с частым исходом в хроническую сердечную недостаточность.
Поражение магистральных артерий головного мозга проявляется симптомами его хронической ишемии с последующим развитием атеросклеротической энцефалопатии и/или инсульта.
Атеросклероз артерий нижних конечностей сопровождается клинической картиной перемежающейся хромоты. При отсутствии соответствующего лечения заболевание прогрессирует и может закончиться развитием гангрены нижних конечностей.
Различают неатероматозные формы атеросклероза (локальную кальцификацию и артериолосклероз) и собственно атеросклероз. С проявлениями общего атеросклеротического процесса могут сочетаться различные другие патогенетические формы поражения сосудистой стенки.
Заболевания, сочетающиеся с ранним артериосклерозом:
1) атеросклероз:
наследственная комбинированная липидемия;
наследственная дисбеталипопротеинемия;
болезнь накопления эфиров холестерина (болезнь Вольмана);
2) неатероматозный артериосклероз:
хроническая почечная недостаточность;
хроническая интоксикация витамином D;
эластическая псевдоксантома;
идиопатическая артериальная кальцификация у детей;
кальцификация клапана аорты у взрослых;
Очаговая кальцификация среднего слоя интимы сосудов, поражающая артерии мышечного типа среднего диаметра, получила название артериосклероза Менкеберга. В этом случае происходит дегенерация гладких мышечных клеток с последующим замещением их кальциевыми отложениями. Сосуды становятся твёрдыми, извитыми. При пальпации артерий, доступных для этого метода исследования (например, лучевой), у врача может возникнуть ощущение, что его пальцы касаются ригидного жгута. Рентгенологически подобные сосуды характеризуются наличием регулярно повторяющихся концентрических кальцификатов преимущественно в сосудистом русле таза и бёдер. Изолированные изменения только срединного слоя не приводят к сужению просвета сосуда и незначительно влияют на кровообращение, вследствие чего имеют небольшое клиническое значение. Однако медиальный склероз сосудов нижних конечностей часто сочетается с атеросклерозом, приводя к окклюзии артерий (частичная или полная блокировка кровотока). Подобные изменения преобладают у людей пожилого возраста и у лиц, длительное время получавших кортикостероиды. У больных сахарным диабетом очаговая кальцификация протекает быстро и принимает тяжёлую форму. Наиболее часто она встречается в тех случаях, когда сахарный диабет осложняется невропатией. При этом считается, что в качестве этиологического фактора выступает симпатическая денервация гладких мышц средней оболочки.
У людей пожилого возраста встречается очаговое кальцифицирующее поражение клапана аорты. С возрастом происходит постепенное накопление кальция на аортальной поверхности клапана, в результате чего появляются различные клинические симптомы, спектр которых варьирует от безобидного систолического шума до тяжёлого кальцифицированного стеноза устья аорты.
Рекомендуемые статьи
Патологическая морфология атеросклероза
Клинические проявления атеросклероза
Алгоритм обследования пациента с атеросклерозом
Инструментальные методы диагностики атеросклероза
Лабораторные методы определения липидов в диагностике атеросклероза