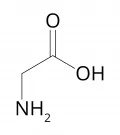
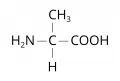
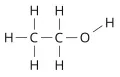
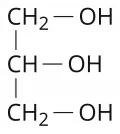
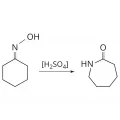
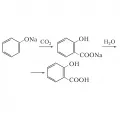
Слоистые дихалькогениды переходных элементов
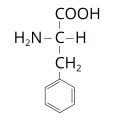
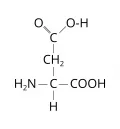
Слои́стые дихалькогени́ды перехо́дных элеме́нтов (TMDC), обширное семейство бинарных халькогенидов, объединённых общей формулой и структурой. Находят применение в создании наноэлектронных устройств. Одним из перспективных направлений использования TMDC является водородная энергетика; также эти соединения могут быть использованы в качестве сенсорных материалов.