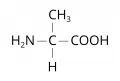
Аланин
Алани́н (α-аминопропионовая кислота, 2-аминопропановая кислота, общепринятые сокращения Ala, A, Ала), NH2CH(CH3)COOH, неполярная алифатическая α-аминокислота. Содержит асимметрический атом углерода, обладает оптической активностью, существует в виде двух энантиомеров – L-аланин и D-аланин. Молярная масса 89,09 г/моль. Плотность 1,424 г/см3 (D-аланин), 1,432 г/см3 (L-аланин). Температура плавления 297 °C (с разложением). Впервые аланин был выделен из фиброина шёлка (1879, Т. Вейль).
L-аланин – протеиногенная α-аминокислота, кодируется триплетами, начинающимися с GC (GCU, GCC, GCA и GCG), содержится практически во всех белках (частота встречаемости 8,72). В плазме крови L-аланин содержится в свободном состоянии, являясь участником глюкозо-аланинового цикла. L- и D-формы аланина присутствуют в бактериальных клеточных стенках, D-аланин входит в состав некоторых пептидных антибиотиков, опиоидных пептидов, служит осмолитиком в тканях ракообразных.
L-аланин может синтезироваться в организме человека и относится к числу заменимых аминокислот.
Физико-химические свойства
Аланин – бесцветное кристаллическое вещество, хорошо растворимое в воде [для L-аланина 16,65 г/100 мл (25 °C), 32,2 г/100 мл (75 °C), для D-аланина 2,2 г/100 мл, для DL-аланина 16,6 г/100 мл (25 °C), 32,2 г/100 мл (75 °C)], умеренно растворимое в этиловом спирте [для L-аланина 0,16 г/100 мл (20 °C), для D-аланина 0,2 г/100 мл (20 °C), для DL-аланина 0,084 г/100 мл (25 °C), 0,57 г/100 мл (75 °C)], пиридине, нерастворимое в диэтиловом эфире, ацетоне.
Как и другие аминокислоты, в кристаллах и полярных растворителях аланин существует в виде цвиттер-иона. Его изоэлектрическая точка равна 6,01. Константы диссоциации кислоты (рКа) составляют 2,34 для карбоксильной группы (α-COOH) и 9,69 для аминогруппы (α-NH3+).
Аланин взаимодействует с кислотами и щелочами, образует комплексы с металлами, вступает в реакции, характерные для карбоновых кислот и аминов, а именно: реакции этерификации, взаимодействие с аминами, декарбоксилирование, реакции с азотистой кислотой, окислительное деаминирование, переаминирование, N-алкилирование, N-ацилирование, образование пептидной связи.
Способы получения
Впервые аланин был синтезирован А. Штреккером в 1850 г. при действии аммиака и синильной кислоты на ацетальдегид с последующим гидролизом образовавшегося α-аминонитрила. Аланин можно также получить при взаимодействии α-хлор- или α-бромпропионовой кислоты с аммиаком.
Аланин выделяют из белковых гидролизатов. Возможен также ферментативный синтез из L-аспарагиновой кислоты под действием аспартат-β-декарбоксилазы (КФ 4.1.1.12).
Участие в обмене веществ
Биосинтез L-аланина из пировиноградной кислоты путём переаминирования тесно связан с обменом других аминокислот в организме. L-аланин является гликогенной аминокислотой, служит ключевым предшественником глюкозы белкового происхождения в организме. Из мышц L-аланин поступает в плазму крови и переносится в печень, где его углеводный скелет используется для синтеза глюкозы, а аминогруппа превращается в мочевину, которая выводится из организма.
L-аланин содержится практически во всех белках. Особенно богаты им β-кератины: например, в фиброине шёлка на долю L-аланина приходится до 40 %. Малый размер бокового радикала L-аланина не препятствует укладке полипептидной цепи в β-слои. L-аланин также участвует в формировании гидрофобных ядер, стабилизирующих пространственную структуру белков.
L- и D-формы аланина в составе пептидогликанов присутствуют в бактериальных клеточных стенках. D-аланин входит в состав некоторых пептидных антибиотиков, например лейнамицина, фузарицидина. D-аланин – один из основных осмолитиков в тканях ракообразных. Кроме того, D-форма аланина обнаружена в опиоидных пептидах дерморфинах, присутствующих в коже южноамериканских лягушек.
β-аланин [CH2(NH2)CH2COOH] в белках не обнаружен; входит в состав дипептидов скелетных мышц (ансерина и карнозина), пантотеновой кислоты.
Применение
L-аланин используется в медицине в составе средств парентерального питания.
Свойство аланина образовывать стабильный свободный радикал при дезаминировании используют для дозиметрии при проведении лучевой терапии.
Малый размер и химическая нейтральность бокового радикала аланина позволяют использовать его для «аланинового сканирования» – замены различных аминокислотных остатков в полипептидной цепи на аланин для оценки их вклада в формирование структуры или осуществление функции белка.