Фенилаланин
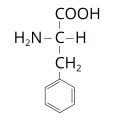
Фенилалани́н (α-амино-β-фенилпропионовая кислота, 2-амино-3-фенилпропановая кислота, общепринятые сокращения: Phe, F, Фен), ароматическая α-аминокислота. Содержит асимметрический атом углерода, обладает оптической активностью, существует в виде двух энантиомеров – L-фенилаланина и D-фенилаланина. В природе преобладает L-форма фенилаланина. Молярная масса 165,19 г/моль. Плотность 1,29 г/см³. Температура плавления 271–273 °C (DL-фенилаланин), 283–284 °C (L-фенилаланин), оба с разложением. Впервые фенилаланин был обнаружен в ростках люпина (1881, Э. Шульце и И. Барбьери). В 1882 г. Э. Эрленмейер и А. Липп синтезировали его из фенилацетальдегида, цианистого водорода и аммиака.
L-фенилаланин – глико-кетогенная аминокислота (аминокислота смешанного типа). Это протеиногенная аминокислота, кодируется триплетами UUU и UUC. Входит в состав белков (частота встречаемости 3,78), нейропептидов, пептидных гормонов, служит предшественником большого числа биологически активных соединений. Фенилаланин – незаменимая для человека аминокислота и должен в достаточном количестве поступать с пищей, рекомендованная ВОЗ норма потребления L-фенилаланина для человека составляет 25 мг на 1 кг веса.
Физико-химические свойства
Фенилаланин – бесцветное кристаллическое вещество, растворимое в воде [для L-фенилаланина 2,83 г/100 мл (16 °C), для D-фенилаланина 3,0 г/100 мл (25 °C), для DL-фенилаланина 1,42 г/100 мл (25 °C), 3,7 г/100 мл (75 °C)], малорастворимое в горячем этаноле (D-фенилаланин), диэтиловом эфире (DL-фенилаланин), нерастворимое в бензоле.
Как и другие аминокислоты, в кристаллах и полярных растворителях фенилаланин существует в виде цвиттер-иона. Его изоэлектрическая точка равна 5,48. Константы диссоциации кислоты (рКа) составляют 1,83 для карбоксильной группы (α-COOH), 9,13 для аминогруппы (α-NH3+).
Фенилаланин взаимодействует с кислотами и щелочами, образует комплексы с металлами, вступает в реакции, характерные для карбоновых кислот и аминов, а именно: реакции этерификации, взаимодействие с аминами, декарбоксилирование, реакции с азотистой кислотой, окислительное дезаминирование, переаминирование, N-алкилирование, N-ацилирование, образование пептидной связи. В реакции с кипящей концентрированной азотной кислотой фенилаланин даёт жёлтый продукт (ксантопротеиновая реакция).
За счёт ароматической фенольной группы фенилаланин может принимать участие в гидрофобных и стэкинг-взаимодействиях, стабилизируя структуру белков.
Способность фенилаланина поглощать ультрафиолетовый свет приводит к характеристической адсорбции белков при длине волны 280 нм, что широко используется в исследовательских целях.
Способы получения
L-фенилаланин в основном получают микробиологической ферментацией. Используя химико-ферментативный метод синтеза, можно получать L-фенилаланин из коричной кислоты под действием фенилаланинаммиаклиазы (КФ 4.3.1.24).
Возможен также химический синтез фенилаланина из бензальдегида, глицина и уксусного ангидрида.
Участие в обмене веществ
Бактерии и растения способны синтезировать L-фенилаланин из хоризмата. Биохимическим предшественником при биосинтезе L-фенилаланина у растений может также служить фенилпируват.
Конечным продуктом катаболизма L-фенилаланина является ацилированное производное кофермента А. Генетические дефекты ферментов – катализаторов этого пути приводят к наследственным заболеваниям людей. Например, на первом этапе в результате гидроксилирования фенилаланина образуется L-тирозин; генетически обусловленное нарушение синтеза ответственного за эту реакцию фермента фенилаланингидроксилазы (КФ 1.14.16.1) приводит к фенилкетонурии.
Образующийся из фенилаланина L-тирозин служит предшественником при синтезе дофамина, меланинов, адреналина и норадреналина. В растениях L-фенилаланин выступает в качестве предшественника большого числа биологически активных веществ, например лигнина, коричной кислоты.
L-фенилаланин входит в состав почти всех белков (кроме протаминов) (7,8 % в сывороточном альбумине, 4,6 % в гамма-глобулине, 7,7 % в овальбумине), пептидных гормонов (например, соматостатина) и опиоидных пептидов (например, энкефалинов), встречается в организмах в свободном состоянии. Остаток D-фенилаланина – компонент пептидных антибиотиков (например, грамицидина S, полимиксинов, тироцидинов), нейропептидов моллюсков и ракообразных.
Применение
Остаток L-фенилаланина входит в состав подсластителя аспартама (пищевая добавка Е 951). В медицине L-фенилаланин применяется в составе средств парентерального питания и средств лечения почечной недостаточности.
Содержание в продуктах питания
№ п/п | Наименование продукта | мг L-фенилаланина / 100 г продукта | |
1 | Рыба и рыбопродукты | Икра кетовая/осетровая | 1643/1445 |
Горбуша | 959 | ||
Тунец | 898 | ||
2 | Мясо | Говядина | 904 |
Баранина | 883 | ||
Телятина | 828 | ||
Свинина | 814 | ||
3 | Птица и яйца | Индейка | 851 |
Куры | 747 | ||
Яйца куриные | 652 | ||
4 | Молоко и молокопродукты | Сыры твёрдые | 920–1560 |
Творог нежирный | 930 | ||
Молоко | 175 | ||
5 | Зерновые и бобовые | Соя | 1610 |
Чечевица | 1250 | ||
Горох | 1010 | ||
Пшеница | 650 | ||
Гречиха | 464 | ||
6 | Семена масличных культур | Соевые | 1696 |
Арахисовые | 1345 | ||
Подсолнечные | 1049 | ||
7 | Овощи | Картофель | 98 |
Капуста белокочанная | 56 | ||
Баклажаны | 55 | ||
8 | Фрукты и ягоды | Груши | 31 |
Земляника (садовая) | 23 | ||
Яблоки | 9 |