Валин
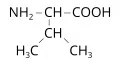
Вали́н (α-аминоизовалериановая кислота, 2-амино-3-метилбутановая кислота, общепринятые сокращения: Val, V, Вал), неполярная алифатическая α-аминокислота с разветвлённой боковой цепью,(CH3)2CHCH(NH2)COOH. Содержит асимметрический атом углерода, обладает оптической активностью, существует в виде двух энантиомеров – L-валина и D-валина. В природе преобладает L-форма валина. Молярная масса 117,16 г/моль. Плотность 1,316 г/см3 (DL-валин), 1,23 г/см3 (L-валин). Температура плавления DL-валина 295–298 °С, D-валина – 293 °С, L-валина – 315 °С. Впервые валин был выделен из казеина (1901, Э. Фишер).
L-валин – протеиногенная аминокислота, кодируется триплетами, начинающимися с GU (GUU, GUC, GUA и GUG), присутствует во всех белках (частота встречаемости 6,74), служит источником энергии в клетках мышц, играет важную роль в метаболизме липидов и глюкозы, влияет на работу иммунной и пищеварительной систем, участвует в синтезе пантотеновой кислоты. D-валин входит в состав некоторых антибиотиков, микотоксинов. L-валин – незаменимая для человека аминокислота, которая должна в достаточном количестве поступать с пищей. Рекомендованная ВОЗ норма потребления L-валина для человека составляет 26 мг на 1 кг веса.
Физико-химические свойства
Валин – бесцветное кристаллическое вещество, хорошо растворимое в воде [для L-валина 9,1 г/100 мл (16,5 °C), для D-валина 5,3 г/100 мл, для DL-валина 7,44 г/100 мл (25 °C), 13,31 г/100 мл (75 °C)], умеренно растворимое в этиловом спирте [для DL-валина 0,571 г/100 мл (25 °C) в 75%-ном, 0,014 г/100 мл (0 °C) в абсолютном], малорастворимое в диэтиловом эфире, бензоле.
Как и другие аминокислоты, в кристаллах и полярных растворителях валин существует в виде цвиттер-иона. Его изоэлектрическая точка равна 5,96. Константы диссоциации кислоты (рКа) составляют 2,32 для карбоксильной группы (α-COOH) и 9,62 для аминогруппы (α-NH3+).
Валин взаимодействует с кислотами и щелочами, образует комплексы с металлами, вступает в реакции, характерные для карбоновых кислот и аминов, а именно: реакции этерификации, взаимодействие с аминами, декарбоксилирование, реакции с азотистой кислотой, окислительное деаминирование, переаминирование, N-алкилирование, N-ацилирование, образование пептидной связи.
Способы получения
DL-валин может быть синтезирован при бромировании изовалериановой кислоты с последующим аминированием α-бром-производного. L-валин получают преимущественно при помощи микробной ферментации.
Участие в обмене веществ
Предшественником L-валина при его биосинтезе в клетках растений, грибов и микроорганизмов является пирувата.
L-валин – гликогенная аминокислота. Катаболизм L-валина преимущественно происходит в мышечной и жировой тканях, в почках, тканях мозга и приводит к образованию сукцинил-производного кофермента А.
L-валин входит в состав белков всех организмов (например, на его долю приходится 7–8 % в казеине молока, альбумине сыворотки крови, инсулине и более 10 % в гемоглобинах). В первую очередь L-валин необходим для биосинтеза белков при росте и формировании тканей организма. Кроме того, наряду с другими аминокислотами с разветвлённой боковой цепью, служит источником энергии в клетках мышц, играет важную роль в метаболизме липидов и глюкозы, влияет на работу иммунной и пищеварительной систем. Эти аминокислоты и их производные могут служить маркерами ряда заболеваний, таких как диабет II типа, онкологических и сердечно-сосудистых. L-валин необходим для поддержания нормального обмена азота в организме.
L-валин встречается в свободном виде (проростки растений, ткани животных), участвует в синтезе пантотеновой кислоты (витамина B5).
L-валин играет существенную роль в организации структуры белков, участвуя в формировании гидрофобных ядер.
Избыточное содержание L-валина в крови человека (гипервалинемия), связанное с наследственным нарушением его переаминирования вследствие недостаточности фермента аминотрансферазы аминокислот с разветвлённой цепью (КФ 2.6.1.42), сопровождается патологическими изменениями в развитии и умственной отсталостью.
Замена L-глутаминовой кислоты в бета-глобине на L-валин служит причиной серповидноклеточной анемии, гидрофобность валина приводит к агрегации гемоглобина.
D-валин входит в состав некоторых антибиотиков (например, валиномицин, грамицидины), микотоксинов (эрготоксины).
Применение
L-валин применяют в медицине в составе средств парентерального питания и ноотропных средств.
Содержание в продуктах питания
№ п/п |
| Наименование продукта | мг L-валина / 100 г продукта |
1 | Рыба и рыбопродукты | Икра кетовая/осетровая | 2144/1878 |
Тунец | 1291 | ||
Горбуша | 1229 | ||
2 | Мясо | Баранина | 1788 |
Телятина | 1156 | ||
Говядина | 1148 | ||
Свинина | 1135 | ||
3 | Птица и яйца | Куры | 1171 |
Индейка | 1017 | ||
Яйца куриные | 772 | ||
4 | Молоко и молокопродукты | Сыры твёрдые | 1420–1915 |
Творог нежирный | 990 | ||
Молоко | 163 | ||
5 | Зерновые и бобовые | Соя | 2090 |
Чечевица | 1270 | ||
Горох | 1010 | ||
Гречиха | 619 | ||
Пшеница | 580 | ||
6 | Семена масличных культур | Соевые | 1737 |
Арахисовые | 1247 | ||
Подсолнечные | 1071 | ||
7 | Овощи | Картофель | 122 |
Баклажаны | 71 | ||
Капуста белокочанная | 58 | ||
8 | Фрукты | Персики | 35 |
Груши | 25 | ||
Яблоки | 12 |