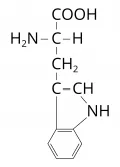
Триптофан
Триптофа́н [β-(β-индолил)-α-аминопропионовая кислота, 2-амино-3-(3-индолил)пропановая кислота, общепринятые сокращения: Trp, W, Три], неполярная ароматическая α-аминокислота, имеющая в боковой цепи ядро индола. Содержит асимметрический атом углерода, обладает оптической активностью, существует в виде двух энантиомеров – L-триптофана и D-триптофана. В природе преобладает L-форма триптофана. Молярная масса 204,22 г/моль. Температура плавления 283–285 °C (D,L-триптофан), 281–282 °C (D-триптофан), 293–295 °C с разложением (L-триптофан). Триптофан впервые был выделен из казеина (1901, Ф. Хопкинс и С. Коул).
L-триптофан – протеиногенная аминокислота, кодируется триплетом UGG. Входит в состав белков (частота встречаемости 1,27), биологически активных пептидов. Промежуточные продукты катаболизма L-триптофана служат предшественниками других важных биологически активных соединений. L-триптофан активно вовлечён в работу нервной системы, иммунитета, пищеварительной системы. L-триптофан – незаменимая для человека аминокислота и должен в достаточном количестве поступать с пищей, рекомендованная ВОЗ норма потребления L-триптофана для человека составляет 4 мг на 1 кг веса.
Физико-химические свойства
Триптофан – бесцветное кристаллическое вещество, растворимое в воде [1,14 г/100 мл (25 °C), 2,79 г/100 мл (75 °C), 4,99 г/100 г (100 °C)], малорастворимое в этаноле, нерастворимое в диэтиловом эфире.
Как и другие аминокислоты, в кристаллах и полярных растворителях триптофан существует в виде цвиттер-иона. Его изоэлектрическая точка равна 5,89. Константы диссоциации кислоты (рКа) составляют 2,38 для карбоксильной группы (α-COOH), 9,39 для аминогруппы (α-NH3+).
Триптофан взаимодействует с кислотами и щелочами, образует комплексы с металлами, вступает в реакции, характерные для карбоновых кислот и аминов, а именно реакции этерификации, взаимодействие с аминами, декарбоксилирование, реакции с азотистой кислотой, окислительное дезаминирование, переаминирование, N-алкилирование, N-ацилирование, образование пептидной связи. В качественных реакциях триптофан даёт окрашенные продукты: с n-Диметиламинобензальдегидом в концентрированной хлористо-водородной кислоте (реакция Эрлиха) – синий, в кислой среде с глиоксиловой кислотой (альдегидами) (реакция Адамкевича) – красно-фиолетовый.
За счёт ароматического индольного ядра триптофан может принимать участие в гидрофобных и стэкинг-взаимодействиях.
Способность триптофана поглощать ультрафиолетовый свет приводит к характеристической адсорбции белков при длине волны 280 нм, что широко используется в исследовательских целях.
Способы получения
Химический синтез триптофана проводят аминометилированием индола по методу Манниха. Полученный 3-(диметиламинометил)-индол конденсируют с эфиром нитроуксусной кислоты, что даёт метиловый эфир 3-индолилнитропропионовой кислоты. Далее восстанавливают нитрогруппу до аминной и после щелочного гидролиза получают триптофан или его натриевую соль.
Химико-ферментативный способ получения L-триптофана состоит в прямой конденсации индола, пировиноградной кислоты и аммиака. Реакция катализируется пиридоксаль-зависимой триптофаназой (КФ 4.1.99.1).
Промышленное производство организовано преимущественно по двухступенчатой схеме – химический синтез антраниловой кислоты с последующим энзиматическим превращением ее в триптофан.
Участие в обмене веществ
Бактерии и растения способны синтезировать L-триптофан из хоризмата. Конечными продуктами деградации L-триптофана являются ацилированное производное кофермента А и пируват.
Некоторые промежуточные продукты катаболизма L-триптофана служат предшественниками других важных биологически активных соединений, например нейромедиатора серотонина, гормона мелатонина, витамина никотиновая кислота у человека, гетероауксинов, индиго и ряда алкалоидов у растений.
L-триптофан содержится во многих природных белках (до 5 % в кональбумине, химотрипсиногене).
L-триптофан активно вовлечён в работу нервной системы, иммунитета, пищеварительной системы. Нарушения обмена L-триптофана и его метаболитов ассоциированы с неврологическими и психическими расстройствами, могут служить показателями онкологических заболеваний, хронической иммунной активации.
D-триптофан был обнаружен в биологически активных пептидах (грамицидины, тироцидин С и др.), нейропептидах и токсинах моллюсков.
Применение
L-триптофан применяется в медицине в составе средств парентерального питания, средств лечения почечной недостаточности, кардиоплегических средств.
Содержание в продуктах питания
№ п/п |
| Наименование продукта | мг L-триптофана /100 г продукта |
1 | Рыба и рыбные продукты | Икра кетовая/осетровая | 379/317 |
Тунец | 292 | ||
Горбуша | 215 | ||
2 | Мясо | Свинина | 274 |
Говядина | 273 | ||
Телятина | 260 | ||
Баранина | 237 | ||
3 | Птица и яйца | Индейка | 354 |
Куры | 315 | ||
Яйца куриные | 204 | ||
4 | Молоко и молокопродукты | Сыры твёрдые | 660–1000 |
Творог нежирный | 180 | ||
Молоко | 50 | ||
5 | Зерновые и бобовые | Соя | 450 |
Горох | 260 | ||
Чечевица | 220 | ||
Пшеница | 150 | ||
Гречиха | 137 | ||
6 | Семена масличных культур | Соевые | 654 |
Подсолнечные | 337 | ||
Горчичные | 335 | ||
7 | Овощи | Картофель | 28 |
Баклажаны | 12 | ||
Капуста белокочанная | 10 | ||
8 | Фрукты и ягоды | Земляника (садовая) | 9 |
Груши | 5 | ||
Яблоки | 3 |