Карбоксипептидазы
Карбоксипептида́зы (С-концевые экзопептидазы), группа протеолитических ферментов, пептидаз, катализирующих реакции отщепления от белков и пептидов С-концевых аминокислотных остатков. Широко распространены в живой природе.
Карбоксипептидазы катализируют разрыв пептидной связи в процессе пищеварения и ремоделирования тканей организма, участвуют в активации и инактивации зимогенов, сигнальных молекул и пептидных гормонов и таким образом влияют на фибринолиз, развитие иммунных реакций и воспаления, репликацию ДНК, эмбриогенез, морфогенез, апоптоз и другие биологические процессы.
Исторически в зависимости от субстратной специфичности выделяли только две основные группы карбоксипептидаз: карбоксипептидазы А (от англ. aliphatic – алифатический), расщепляющие пептидные связи, образованные алифатическими и ароматическими аминокислотами; карбоксипептидазы B (от англ. basic – основной), гидролизующие связи, образованными осно́вными аминокислотами (например, аргинин, лизин).
Сегодня известно несколько десятков карбоксипептидаз. В зависимости от механизма каталитического действия выделяют три группы:
серинкарбоксипептидазы [код классификации ферментов (КФ) 3.4.16], в активном центре которых используются остатки серина. Обнаружены в вакуолях растений и грибов, а также в лизосомах простейших и в животных клетках;
металлокарбоксипептидазы (КФ 3.4.17), входящие в группу металлопротеинов, т. е. содержащие в своём активном центре ионы металлов (чаще цинк Zn2+, реже кобальт Co2+, никель Ni2+ и др.);
цистеинкарбоксипептидазы, или тиолкарбоксипептидазы (КФ 3.4.18), в активном центре которых находится остаток цистеина.
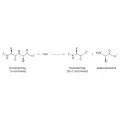
Наиболее изучены карбоксипептидазы А и В высших животных и человека; они синтезируются в поджелудочной железе в виде зимогенов – прокарбоксипептидаз; попадая в двенадцатиперстную кишку, они активируются под действием трипсина. В формировании их активного центра участвуют ионы Zn2+; оптимум действия при pH 7,5. Панкреатические карбоксипептидазы участвуют в пищеварении, расщепляя до аминокислот продукты первичного переваривания белков.
В плазме крови животных и человека присутствует металлокарбоксипептидаза N, или кининаза I (КФ 3.4.17.3), которая выделяется клетками печени. Она, отщепляя С-концевой остаток аргинина, инактивирует брадикинин и его аналоги, обладающие гипотензивным действием, а также анафилотоксины, образующиеся при активации системы комплемента. Сходный эффект наблюдается при действии цистеинкарбоксипептидазы – катепсина X (КФ 3.4.18.1); ранее этот фермент считался противовоспалительным маркером, сейчас доказано, что он отщепляет аминокислотные остатки от каллидина и брадикинина и влияет на их способность связываться с рецепторами брадикинина В1 и В2.
Карбоксипептидаза U (КФ 3.4.17.2), или TAFI (тромбин-активируемый ингибитор фибринолиза), участвует в регуляции фибринолитического процесса. Внеклеточная карбоксипептидаза М (КФ 3.4.17.12) является компонентом посттрансляционной модификации пептидных гормонов, равно как и внутриклеточная карбоксипептидаза H (КФ 3.4.17.10), которая участвует в процессинге многих энкефалинов, окситоцина, вазопрессина, адренокортикотропного и меланоцитстимулирующего гормонов и др.
В биохимии карбоксипептидазы используются для определения С-концевых аминокислотных остатков в белках. В пищевой промышленности карбоксипептидазы применяются для развития вкуса и ускорения созревания сыра, ферментированного мяса и др.