Протеазы
Протеа́зы (протеолитические ферменты), группа ферментов класса гидролаз, катализируют внутри- и внеклеточное расщепление (протеолиз) пептидных связей C(O)–NH в белках и пептидах живых организмов.
Выделяют 2 подгруппы протеаз:
экзопептидазы (пептидазы), отщепляют аминокислоты с аминного (аминопептидазы) или карбоксильного (карбоксипептидазы) конца молекулы белка или пептида;
эндопептидазы (протеиназы; этот термин иногда используется также как синоним термина «протеазы»), гидролизуют преимущественно внутренние пептидные связи.
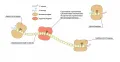 Протеолитические ферменты.
Протеолитические ферменты.
Большинство изученных протеаз синтезируются в виде неактивных предшественников – проферментов, или зимогенов. Их активация происходит путём ограниченного протеолиза – избирательного гидролиза определённых пептидных связей, протекающего либо автокаталитически, либо под действием других протеиназ, – и обычно сопровождается отщеплением пептидов.
Протеазы разнообразны по физико-химическим свойствам. В зависимости от локализации протеолитических ферментов протеолиз происходит при различных значениях pH. Например, пепсин и гастриксины желудка – при pH 1,5–2, ферменты лизосом – при pH 4–5, протеазы сыворотки крови, тонкого кишечника – при нейтральных или слабощелочных значениях. Некоторые протеазы (в том числе коллагеназа, термолизин) в качестве кофактора используют ионы металлов.
Протеолитические ферменты имеют разную субстратную специфичность, которая определяется в основном особенностями боковых групп аминокислот. Так, например, трипсин гидролизует связи, образованные карбоксильной группой осно́вных аминокислот – лизина и аргинина, а эластаза – аминокислот с небольшими боковыми цепями: аланина и серина. На расщепление пептидных связей влияет также их доступность при наличии пространственной структуры гидролизуемого субстрата. Ферменты с узкой субстратной специфичностью (например, коллагеназа, калликреин) гидролизуют пептидные связи, образованные строго определёнными аминокислотными остатками, ферменты с широкой субстратной специфичностью (в том числе пепсин, папаин) – связи, образованные многими аминокислотами.
В плазме крови и других биологических жидкостях, а также в разных клетках и тканях присутствуют белковые ингибиторы протеаз, которые могут блокировать активность отдельных ферментов или групп ферментов. Благодаря ингибиторам осуществляется регуляция активности протеаз в физиологических условиях, что предохраняет белки от неконтролируемого расщепления.
К протеазам относятся многие пищеварительные ферменты. Основная часть протеолитических ферментов клеток локализована в лизосомах (например, катепсины), в которых в основном и происходит внутриклеточный распад белков. Протеазы участвуют в образовании и разрушении различных биологически активных пептидов (в том числе кининов, пептидных гормонов, нейропептидов), играют важную регуляторную роль в обмене веществ, катализируя образование и инактивацию ферментов, участвуют в процессах оплодотворения, свёртывания крови, фибринолиза, в активации системы комплемента, гормональной регуляции и др. Нарушение механизмов регуляции активности протеаз служит причиной многих заболеваний (мышечной дистрофии, эмфиземы лёгких, панкреатитов, аутоиммунных заболеваний и др.).
Протеазы используют при установлении первичной структуры белков, в медицине для коррекции нарушений пищеварения, заживления ран и ожогов, рассасывания тромбов и др. Они нашли применение в производстве гормональных препаратов и антибиотиков, в пищевой (например, в сыроварении, для смягчения мяса) и лёгкой (в том числе для удаления шерсти со шкур, мягчения кож) промышленности, в производстве моющих средств и т. д.