Цистеин
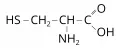
Цистеи́н (α-амино-β-тиопропионовая кислота, 2-амино-3-меркаптопропановая кислота, общепринятые сокращения Cys, C, Цис), HSCH2CH(NH2)COOH, алифатическая серосодержащая α-аминокислота. Содержит асимметрический атом углерода, обладает оптической активностью, существует в виде двух энантиомеров – L-цистеин и D-цистеин. В природе преобладает L-форма цистеина. Молярная масса 121,16 г/моль. tпл 178 °C с разложением (гидрохлорид). В 1884 г. О. Бауман восстановлением получил цистеин из цистина.
L-цистеин – гликогенная аминокислота. Протеиногенная аминокислота, кодируется триплетами UGU и UGC, присутствует во всех белках (частота встречаемости 1,46), участвует в синтезе значительного числа биологически активных соединений.
L-цистеин является заменимой для человека аминокислотой (синтезируется в организме в достаточном количестве).
Физико-химические свойства
Цистеин – бесцветное кристаллическое вещество, очень хорошо растворимое в воде, уксусной кислоте, этаноле, малорастворимое в уксусной кислоте, нерастворимое в диэтиловом эфире, ацетоне, бензоле.
Как и другие аминокислоты, в кристаллах и полярных растворителях цистеин существует в виде цвиттер-иона. Его изоэлектрическая точка равна 5,02. Константы диссоциации кислоты (рКа) составляют 1,71 для карбоксильной группы (α-COOH), 10,78 для аминогруппы (α-NH3+) и 8,27 (SH-группа).
Цистеин взаимодействует с кислотами и щелочами, образует комплексы с металлами, вступает в реакции, характерные для карбоновых кислот и аминов, а именно: реакции этерификации, взаимодействие с аминами, декарбоксилирование, реакции с азотистой кислотой, окислительное деаминирование, переаминирование, N-алкилирование, N-ацилирование, образование пептидной связи.
При участии тиольной группы цистеин может образовывать меркаптиды с ионами тяжёлых металлов, легко окисляется. Подвижный атом водорода в тиогруппе обеспечивает лёгкость протекания различных реакций замещения.
Качественные реакции на цистеин с нитропруссидом натрия в разбавленном растворе аммиака (нитропруссидная реакция) и с 1,2-нафтохинон-4-сульфонатом натрия и бисульфитом натрия (реакция Салливена) дают продукты красного цвета. При нагревании с ацетатом свинца образуется черный осадок (реакция Фоля).
Высокая реакционная способность SH-группы обусловливает активность т. н. тиоловых ферментов, среди которых имеются ферменты всех классов.
Остатки L-цистеина участвуют в образовании «цинковых пальцев» – элемента пространственной структуры белков, важного для их взаимодействия с нуклеиновыми кислотами.
Способы получения
Цистеин получают экстракцией из белковых гидролизатов. Более современным является синтез L-цистеина из глюкозы прямой ферментацией.
Участие в обмене веществ
Растения и микроорганизмы используют для синтеза L-цистеина L-серин и сульфат из окружающей среды, животные – L-серин и L-метионин. Конечным продуктом катаболизма L-цистеина является пируват.
В виде L-изомера цистеин входит в состав различных природных белков [особенно много его в кератинах (кератин волос – 14,4%, перьев – 8,2%, шерсти – 11,9%)] и некоторых пептидов (например, глутатион).
В составе белковых молекул L-цистеин легко подвергается окислению с образованием остатков L-цистина, которые способствуют поддержанию структуры белков.
L-цистеин участвует в биосинтезе L-метионина (у растений и микроорганизмов), таурина и кофермента А, в обмене серосодержащих соединений.
Биолюминесценция светлячков Luciola lateralis обусловлена D-формой люциферина, содержащего остаток D-цистеина.
Применение
В медицине используют антиоксидантные свойства L-цистеина. L-цистеин участвует в обезвреживании некоторых токсических веществ (например, тяжёлых металлов), защищает организм от повреждающего действия радиации.
L-цистеин и его гидрохлориды (натриевая и калиевая соли) – пищевая добавка Е920 (улучшители муки и хлеба).