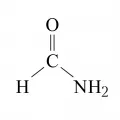
Формамид
Формами́д (метанамид, формимидиновая кислота), амид муравьиной кислоты HCONH2, молярная масса 45,041 г/моль. Представляет собой бесцветную гигроскопическую жидкость без запаха; tпл 2,55 °C, tкип 210,5 °C; tвсп 175 °C, tсамовоспл > 500 °C; плотность 1,1334 г/см3 при 20 °C, показатель преломления 1,4475; вязкость 3,76 мПа · с, поверхностное натяжение 58,2 мН/м (20 °C), абсолютная величина дипольного момента 11,24 10−30 Кл·м; давление пара (кПа): 0,13 (70,5 °C), 2,67 (122,5 °C), 13,33 (157,5 °C), 53,32 (193,5 °C); теплоёмкость при постоянном давлении 2,3 кДж/(кг · К) (19 °C); энтальпия испарения 1673 кДж/кг, энтальпия сгорания −12530 кДж/кг, энтальпия образования −3529 кДж/кг; теплопроводность 0,352 Вт/(м·К), диэлектрическая проницаемость 109 ± 1,5 (25 °C).
Формамид хорошо растворяется в воде, низших спиртах, органических кислотах, эфирах, гликолях, ацетоне, феноле, хлороформе, не растворяется в углеводородах, некоторых хлоруглеводородах, нитробензоле. Формамид – хороший растворитель для неорганических солей; растворяет казеин, желатин, животный клей, не растворяет углеводороды, жиры и масла. Высокомолекулярные полимеры и природные продукты либо растворяются в формамиде, либо набухают в нём.
По химическим свойствам формамид – типичный представитель алифатических амидов карбоновых кислот. При температуре ниже 100 °C устойчив к действию света и O2 воздуха, выше 160 °C начинается разложение, которое при температуре кипения составляет 0,5 % в мин. Продукты разложения главным образом монооксид углерода СО и аммиак NH3, а также небольшие количества циановодорода HCN и H2O. При температурах выше 500 °C в присутствии воздуха и катализатора (оксид алюминия Al2O3, алюмосиликат) формамид дегидратируется до HCN (выход 90 %). При комнатной температуре формамид устойчив к воде, при повышенной температуре в присутствии кислот и щелочей гидролизуется до муравьиной кислоты и NH3, которые образуют формиат аммония. При реакции формамида с серной кислотой H2SO4 образуется муравьиная кислота с почти количественным выходом, при реакции с метилатом натрия CH3ONa – диформиламид натрия, с ацилхлоридами – триациламины. Алкоголиз формамида приводит к эфирам муравьиной кислоты.
В промышленности формамид получают: 1) прямым синтезом из NH3 и СО при 80–100 °C и 10–30 МПа в метанольном растворе CH3ONa; из реакционной смеси извлекают метанол CH3OH, затем удаляют катализатор и соли и перегоняют формамид; 2) при двухстадийном способе сначала получают метилформиат реакцией СО и CH3OH в присутствии каталитических количеств CH3ONa, а далее очищенный метилформиат вводят в реакцию с NH3 (жидким или газообразным) при 80–100 °C и 0,2–0,6 МПа. Выделяющийся метанол отправляют в рецикл. При двухстадийном синтезе получаются более чистые формамид и CH3OH и упрощается их очистка.
Формамид – растворитель, мягчитель для бумаги, входит в состав мазей для бальзамирования. Сырьё для синтеза муравьиной кислоты, а также различных гетероциклов (имидазола, пиримидина, триазина и др.) и некоторых алкалоидов.
Формамид действует на нервную и сосудистую системы, паренхиматозные органы (особенно на печень), на плод; проникает через неповреждённую кожу, обладает способностью к кумуляции.
Предельно допустимая концентрация в атмосфере воздуха 0,035 мг/м3, в воздухе рабочей зоны 0,5 мг/м3, в воде водоёмов хозяйственно-бытового пользования 0,5 мг/л.