Силиконы
Силико́ны (полиорганосилоксаны), полимерные соединения, состоящие из чередующихся атомов кремния и кислорода, с различными органическими заместителями у атомов кремния. Термин введён английским химиком Ф. С. Киппингом в 1901 г. для описания формулы полидифенилсилоксана Ph2SiO по аналогии с формулой бензофенона Ph2CO (Kipping. 1901. P. 449−459). В строении таких макромолекул могут присутствовать атомы кремния с тремя, двумя и одним органическим радикалом, а также без органических заместителей.
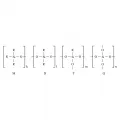 Элементарные звенья полиорганосилоксанов.Показатели k, l, m, n могут иметь значения от 0 и далее, с различными соотношениями. В литературе приняты обозначения звеньев по числу кислородных связей – M, D, T, Q. Наиболее широко распространены полиорганосилоксаны с метильными, этильными и фенильными группами (R = Me, Et, Ph), однако возможны и другие варианты.
Элементарные звенья полиорганосилоксанов.Показатели k, l, m, n могут иметь значения от 0 и далее, с различными соотношениями. В литературе приняты обозначения звеньев по числу кислородных связей – M, D, T, Q. Наиболее широко распространены полиорганосилоксаны с метильными, этильными и фенильными группами (R = Me, Et, Ph), однако возможны и другие варианты.
Физико-химические свойства силиконов
В зависимости от величин и соотношения показателей k, l, m, n, силиконовые полимеры представляют собой жидкости (олигомерные соединения), эластомеры (от ~3000 а. е. м. до ~10 000 а. е. м.), гели (слабо сшитые полимеры) и смолы [высокая степень сшивки, т. е. значительное количество звеньев k и n; MQ-смолы – растворимые сополимеры, состоящие из звеньев k (М) и n (Q)]. Природа органического радикала у атома кремния определяет подвижность силоксановой цепи, межмолекулярное взаимодействие и, соответственно, свойства полимерной цепи.
Силиконовые продукты обладают отличными электроизоляционными свойствами, высокой термической устойчивостью, низкими температурами стеклования, биологической инертностью, прозрачностью в УФ- и видимой областях спектра и обусловленной этим светостойкостью. Важной особенностью является высокая газопроницаемость полиорганосилоксанов, а также низкая токсичность и гидрофобность (Noll. 1968).
Получение силиконовых полимеров
Исходным веществом для производства силиконов является кремнезём SiO2, т. е. песок. По распространённости в земной коре кремний занимает 2-е место после кислорода (~30 % по массе), что определяет возможность практически неограниченного роста производства силиконов.
Процесс производства силиконов состоит из следующих этапов: производство чистого кремния, производство функциональных силанов, получение функциональных органосиланов и последующее получение полиорганосилоксанов на их основе.
Производство чистого кремния
 Песок кварцевый. Антоново озеро (Новгородская область, Россия).
Образец из коллекции Д. В. Обручева. Фото: Л. Р. Колбанцев.Производство кремния осуществляется с помощью двух основных технологий. Первый вариант заключается в прокаливании белого песка, представляющего собой чистый диоксид кремния SiO2, с активными металлами (чаще с магнием). В результате образуется свободный кремний в виде аморфной модификации. Чистота такого кремния достигает 99,9 %. Второй вариант, более распространённый в промышленности, разработан русским учёным Н. Н. Бекетовым, – восстановление SiO2 спеканием расплава песка с коксом при температуре около 1800 °C в дуговых печах. Чистота полученного таким образом кремния составляет около 99 %.
Песок кварцевый. Антоново озеро (Новгородская область, Россия).
Образец из коллекции Д. В. Обручева. Фото: Л. Р. Колбанцев.Производство кремния осуществляется с помощью двух основных технологий. Первый вариант заключается в прокаливании белого песка, представляющего собой чистый диоксид кремния SiO2, с активными металлами (чаще с магнием). В результате образуется свободный кремний в виде аморфной модификации. Чистота такого кремния достигает 99,9 %. Второй вариант, более распространённый в промышленности, разработан русским учёным Н. Н. Бекетовым, – восстановление SiO2 спеканием расплава песка с коксом при температуре около 1800 °C в дуговых печах. Чистота полученного таким образом кремния составляет около 99 %.
Производство функциональных силанов
Переход к силиконовым (полиорганосилоксановым) полимерам определяется получением мономерных функциональных соединений кремния, или функциональных силанов. Наиболее ценные функциональные группы – гидролизуемые Si–Cl и Si–OAlk (Alk = алкил), пригодные для реакции силилирования Si–H и Si–Vin (Vin = винил); ацетокси-, амино- и эпоксигруппы для реакций сшивания.
Процесс получения функциональных силанов на основе чистого кремния, т. н. прямой синтез, в случае хлорфункциональных метилсиланов, наиболее широко применяемых мономеров, идёт через последовательное образование комплекса Si с железом или медью и промежуточного соединения – хлорметилсилилена (Rochow. 1948. P. 2170–2171; О механизме реакций ... 1963). При получении функциональных фенил- и этилхлорсиланов применяется магнийорганический синтез в инертных органических растворителях, в том числе как непрерывный процесс (Клоков. 1994. С. 1703–1707).
Получение функциональных органосиланов
Введение органических заместителей к атому кремния для получения мономеров RnSiX4–n, где n = 0, 1, 2, 3, осуществляют реакциями гидросилилирования, гидротиолирования и присоединения по Михаэлю, а также металлоорганическим синтезом.
Гидросилилирование
Среди продуктов реакции прямого синтеза всегда присутствуют гидридсодержащие трихлорсилан (SiHCl3) и дихлорсиланы. Группа Si–H в этих продуктах позволяет получать различные органохлорсиланы c использованием реакции гидросилилирования алкенов и алкинов в присутствии комплексов переходных металлов.
Гидротиолирование
Реакция заключается в гидридном присоединении меркаптогруппы к ненасыщенной связи. Наличие коммерчески доступного ряда тиолсодержащих алкоксисиланов делает этот способ перспективным, в том числе в промышленном производстве.
Присоединение по Михаэлю
Реакция присоединения по Михаэлю, т. н. сопряжённое присоединение, является одной из разновидностей гидридного присоединения и осуществляется за счёт взаимодействия между нуклеофилом и активированными олефинами и алкинами. Данный процесс охватывает присоединение амино-, меркапто- или гидроксильной группы к двойной связи или эпоксидной группе. Все процессы идут в присутствии оснований и кислот Льюиса. В качестве акцепторов может выступать широкий ряд коммерчески доступных соединений, таких как акриловые эфиры, акрилонитрил, акриламиды, малеимиды, алкилметакрилаты, цианоакрилаты и винилсульфоны.
Металлоорганический синтез органосиланов
Метод основан на взаимодействии магний- и других металлорганических реагентов с хлор- и алкоксисиланами. Способ позволяет получить органосиланы как с насыщенными, так и ненасыщенными углеводородными заместителями. При использовании металлорганических реагентов с объёмными заместителями, такими как трет-бутил и фенил, реакция протекает более селективно и позволяет получать органосиланы заданного состава. В некоторых случаях эту реакцию проводят в присутствии солей меди в качестве катализатора, что существенно увеличивает селективность процесса. Алкоксисиланы менее реакционноспособны, чем соответствующие хлорсиланы, что позволяет более тонко регулировать степень замещения алкоксигрупп в исходном субстрате (Expedient, Direct Synthesis ... 2007; The aza-Michael reaction ... 2017).
Получение полиорганосилоксанов (силиконов)
Полиорганосилоксаны получают полимеризацией функциональных органосилоксанов RnSiX4–n (где R – органический радикал, преимущественно R = CH3–, C2H5–, C6H5–, однако возможны и другие варианты, в том числе фторированные алкилы; X – функциональная группа, X = Cl, OAlk, OAc; n = 0–3). Природа функциональной группы определяет способ полимеризационного подхода к синтезу полимеров.
Полиорганосилоксановые макромолекулы получают гидролитической поликонденсацией функциональных органосиланов или ионной полимеризацией с раскрытием цикла предварительно синтезированных органоциклосилоксанов.
Гидролитическая поликонденсация функциональных органосиланов
Наиболее широко используемый метод получения полиорганосилоксановой полимерной цепи – гидролитическая поликонденсация функциональных органосиланов с хлор-, алкокси-, ацилокси- и аминогруппами. Метод основан на гидролизе функциональных групп, ведущих к образованию неустойчивых органосиланолов, которые далее конденсируются с образованием линейных и разветвлённых олигомеров или циклосилоксанов.
Гидролитическая поликонденсация дифункциональных силанов R2SiX2 приводит к образованию смеси олигодиорганосилоксанов линейного и циклического строения, соотношение и молекулярно-массовые характеристики которых в продукте реакции зависят от условий проведения процесса. Процесс является основополагающим в химии промышленных силиконов, т. к. основную долю всего спектра силоксановых продуктов занимают каучуки, гомо- и сополимерные жидкости, эластичные связующие, содержащие диорганосилоксановые звенья.
В зависимости от типа органического радикала у атома кремния и условий осуществления процесса, при поликонденсации силанов RSiX3 образуются разнообразные продукты: от жидких сверхразветвлённых полимеров до твёрдых кристаллических порошков (в случае кубических силсесквиоксанов). При этом все полимеры отличаются высокой термостойкостью на воздухе: МеSiO1,5 стабилен до ~400 °C, [PhSiO1,5]8 – до 500 °C, полифенилсилсесквиоксан – до 600 °C.
Процесс гидролитической поликонденсации силанов SiX4 приводит к образованию нано- и микроразмерных кремнезёмных частиц, величина, плотность и полидисперсность которых зависит от условий проведения процесса. Наиболее эффективные золь-гель процессы гидролиза или согидролиза тетраалкоксисиланов приводят к получению различных наноструктурированных полимеров.
Промышленный способ получения силиконов путём гидролитической поликонденсации диорганодихлорсиланов представляет собой сложный массообменный процесс, состоящий из ряда химических реакций: гидролиза хлорсилильных групп, гомо- и гетерофункциональной меж- и внутримолекулярной конденсации с образованием линейных макромолекул и диорганоциклосилоксанов, количество которых в смеси зависит от соотношения исходных силанов и воды, природы органических заместителей у атома кремния, pH реакционной среды, отсутствия или наличия растворителя и его природы. Наличие солянокислых отходов, усложняющих выделение продукта и утилизацию образовавшихся отходов, – основной недостаток использования органохлорсиланов.
Гидролитическая поликонденсация органоалкоксисиланов не сопровождается образованием хлористого водорода, не требует специального оборудования и ряда стадий для нейтрализации. При этом природа органического радикала у атома кремния влияет как на скорость гидролиза алкоксигрупп и конденсации продуктов гидролитической поликонденсации, так и на состав и структуру образующихся продуктов. Скорость гидролиза алкоксигрупп в нейтральных условиях снижается в ряду: CH3, C2H5, n-C3H7, n-C4H9, C6H11. Фенильный заместитель у атома кремния приводит к большей стабильности гидроксигрупп, что замедляет процесс. Тип алкоксигрупп также влияет на гидролитическую поликонденсацию метилтриалкоксисиланов. Увеличение объёма алкоксильной группы снижает скорость гидролитической поликонденсации алкоксисиланов.
Наиболее эффективен метод поликонденсации алкоксисиланов в безводных карбоновых кислотах (прежде всего уксусной), в т. н. активной среде, без введения дополнительных растворителей. Гидролиз алкоксигрупп протекает в гомогенных условиях с участием воды, образующейся в ходе реакции ацидолиза алкоксисилана. Метод используется для получения в одном реакторе низкомолекулярных олигомеров, высокомолекулярных полиорганосилоксанов и сополимерных продуктов, в том числе MQ-смол, и не требует проведения дополнительных стадий выделения и очистки.
На стадии разработок находятся «зелёные» методы синтеза полиорганосилоксанов на основе алкоксисиланов с использованием растворителей под давлением, включая сверхкритические среды (прежде всего сверхкритический диоксид углерода) и сжатые бифазные системы. Варьирование параметров системы (плотность, давление, количество фаз, интенсивность перемешивания) позволяет влиять на характеристики конечного продукта. Также достоинством синтеза силиконов на основе алкоксисиланов при высоком давлении является возможность регулировать ход процесса изменением параметров реакционной смеси и типа органического заместителя в алкоксисилане (Condensation of methylphenylalkoxysilanes ... 2011).
Ионная полимеризация циклосилоксанов с раскрытием цикла
Ионная полимеризация органоциклосилоксанов с раскрытием цикла (ring-opening polymerization, ROP) соответствует общим закономерностям ионной полимеризации гетероциклических мономеров и включает в себя стадии инициирования, роста и передачи или обрыва цепи примесями или монофункциональными реагентами – регуляторами молекулярной массы. Процесс проводят в присутствии нуклеофильных или электрофильных реагентов. В промышленной практике находят применение оба способа полимеризации. Выбор типа катализатора определяется природой радикалов у кремния, влияющих на реакционную способность силоксановых связей, а также числом звеньев в цикле.
Катионная полимеризация
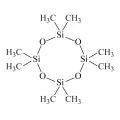 Структурная формула октаметилциклотетрасилоксана.При катионной полимеризации (cationic ring-opening polymerization, CROP) атом кислорода силоксановой связи атакуется электрофилом инициатора. Преимущества способа: невысокая температура процесса, лёгкая дезактивация и возможность синтеза полисилоксанов, имеющих чувствительные к основанию заместители, такие как Si–H или Si–(CH2)3–SH. Исторически первый высокомолекулярный силоксановый полимер был получен катионной полимеризацией октаметилциклотетрасилоксана D4 с раскрытием цикла в присутствии серной кислоты при комнатной температуре, что приводило к образованию низкомолекулярных полимеров, которые затем доконденсировали (Carmichael. 1965). В качестве катализатора могут использоваться ионообменные смолы, обработанные кислотой графит или глина, трифторметансульфокислота, хлорная кислота, арилалкилсульфоновые кислоты, некоторые кислоты Льюиса, а также неорганические кислотные катализаторы (например, синтетические и природные алюминаты кремния) (Ganache. 2009. P. 65–95). В условиях катионного процесса при сополимеризациях октаметилциклотетрасилоксана с гидридфункциональными олигомерами в присутствии смолы сульфоновой кислоты получают гидрид- и карбоксипропилфункциональные полидиметилсилоксаны (Synthesis and thermal and rheological properties ... 2017).
Структурная формула октаметилциклотетрасилоксана.При катионной полимеризации (cationic ring-opening polymerization, CROP) атом кислорода силоксановой связи атакуется электрофилом инициатора. Преимущества способа: невысокая температура процесса, лёгкая дезактивация и возможность синтеза полисилоксанов, имеющих чувствительные к основанию заместители, такие как Si–H или Si–(CH2)3–SH. Исторически первый высокомолекулярный силоксановый полимер был получен катионной полимеризацией октаметилциклотетрасилоксана D4 с раскрытием цикла в присутствии серной кислоты при комнатной температуре, что приводило к образованию низкомолекулярных полимеров, которые затем доконденсировали (Carmichael. 1965). В качестве катализатора могут использоваться ионообменные смолы, обработанные кислотой графит или глина, трифторметансульфокислота, хлорная кислота, арилалкилсульфоновые кислоты, некоторые кислоты Льюиса, а также неорганические кислотные катализаторы (например, синтетические и природные алюминаты кремния) (Ganache. 2009. P. 65–95). В условиях катионного процесса при сополимеризациях октаметилциклотетрасилоксана с гидридфункциональными олигомерами в присутствии смолы сульфоновой кислоты получают гидрид- и карбоксипропилфункциональные полидиметилсилоксаны (Synthesis and thermal and rheological properties ... 2017).
Анионная полимеризация
Анионная полимеризация (anionic ring-opening polymerization, AROP) под действием различных нуклеофильных реагентов используется для синтеза высокомолекулярных полидиорганосилоксановых полимеров с различным органическим обрамлением силоксановой цепи. При реакциях раскрытия циклосилоксана и роста цепи возможно протекание побочных процессов: деполимеризации за счёт разрыва линейной цепи активным центром с образованием низкомолекулярных циклических продуктов; передачи цепи, приводящей к рандомизации макромолекул. В качестве инициаторов процесса используют гидроксиды щелочных металлов, четвертичных аммониевых и фосфониевых оснований и их производных – силоксанолятов. В ряду гидроксидов и силоксанолятов щелочных металлов активность инициаторов уменьшается в ряду Cs > Rb > K > Na > Li. Повышение полярности среды процесса приводит к значительному повышению скорости полимеризации циклосилоксанов. Силоксаноляты тетраметиламмония и тетрабутилфосфония сопоставимы по активности с соединениями Cs, при этом такие инициаторы дезактивируются при нагревании полимера и стадия блокирования концевых групп не требуется.
Значительно отличаются процессы полимеризации напряжённого гексаметилциклотетрасилоксана, что определяет тепловой эффект полимеризации (3–4 ккал/моль) и возможность осуществления неравновесного процесса в отсутствие деполимеризации и межцепного обмена, от процессов полимеризации ненапряжённых циклосилоксанов с числом звеньев n > 3. Неравновесный процесс позволяет получать полимеры с регулируемой молекулярной массой, заданными концевыми группами и узким молекулярно-массовым распределением (Synthesis and characterization ... 1995). При числе звеньев исходных циклосилоксанов n > 3 ионные активные центры одновременно атакуют связи Si–O циклосилоксана и линейного полимера, т. е. полимеризация сопровождается деполимеризацией, процесс имеет равновесный характер, в результате чего образуется смесь линейных и циклических силоксанов. Положение равновесия при этом не зависит от температуры, так же как и от природы катализатора и растворителя (Kantor. 1954; Carmichael. 1965). Изменение природы органических групп у атомов кремния в циклосилоксанах существенно влияет как на напряжённость циклов, так и на активность концевой силанолятной группы и в каждом случае требует подбора оптимальных условий осуществления процесса ROP. Введение алкильных электронодонорных заместителей (этильных, пропильных и т. д.) снижает скорость анионной полимеризации циклосилоксана, тогда как электроноакцепторные заместители (алкенильные, ароматические, фенильные, 3,3,3-трифторпропильные или цианалкильные группы) увеличивают скорость полимеризации (Андрианов. 1968).
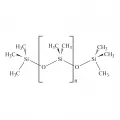 Структурная формула полидиметилсилоксана.Равновесная сополимеризация двух или нескольких циклосилоксанов, содержащих различные радикалы у атома кремния, позволяет получать статистические сополимеры с неупорядоченным расположением различных звеньев, например наиболее важные винилсодержащие полидиметилсилоксановые каучуки СКТВ (синтетический каучук термостойкий высокомолекулярный), а также функциональные аминопропильные полидиметилсилоксановые телехелики (A self-healing polysiloxane elastomer ... 2018).
Структурная формула полидиметилсилоксана.Равновесная сополимеризация двух или нескольких циклосилоксанов, содержащих различные радикалы у атома кремния, позволяет получать статистические сополимеры с неупорядоченным расположением различных звеньев, например наиболее важные винилсодержащие полидиметилсилоксановые каучуки СКТВ (синтетический каучук термостойкий высокомолекулярный), а также функциональные аминопропильные полидиметилсилоксановые телехелики (A self-healing polysiloxane elastomer ... 2018).
Области применения силиконов
В автомобилестроении используются силиконовые уплотнители и смазки, стабильные при высоких температурах, а также тормозные жидкости. Аэрокосмические марки силикона, стабильные при температуре от −70 до 220 °C, используют при изготовлении прокладок для окон и дверей кабин самолётов. Силиконовые герметики применяются в строительной отрасли для заделки зазоров, швов и щелей; силиконовые плёнки – в качестве прочных гидрофобных покрытий, в том числе на ветровых стёклах самолётов. В электронике силикон используется для заливки (герметизации) компонентов, повышения устойчивости к механическим и электрическим ударам, радиации и вибрации в широком диапазоне рабочих температур (от −65 до 315 °C), в полимерной 3D-печати, а также в качестве термопаст для отвода тепла, используемых для улучшения теплопередачи от электронных компонентов. Благодаря низкой токсичности силикон используют в производстве пищевой посуды, а также для изготовления медицинских изделий, требующих высокой биосовместимости; в гелевой форме – для изготовления перевязочных материалов, имплантов и контактных линз (Полимеры будущего. 2022).
Уникальный и универсальный комплекс свойств, биологическая инертность и перерабатываемость силиконов в исходные вещества позволяют рассматривать их как один из самых перспективных материалов будущего. Силиконы представлены в многочисленных полимерных формах, таких как дендримеры, наногели, многолучевые звёзды и плотные молекулярные щётки, которые открывают всё более инновационные области применения. С начала 21 в. производство силиконов растёт со скоростью 5–7 % в год (Бесхлорная химия силиконов – дорога в будущее. 2018).
Недостатком силиконов является их относительно высокая стоимость и подверженность деструкции в ионных средах.
Переработка силиконов
Силиконы не относятся к биоразлагаемым материалам. Подверженность силоксановой цепи ионным атакам позволяет перерабатывать такие материалы под действием ионных реагентов (щелочей, кислот); продукты переработки используют для приготовления различных резиновых смесей и компаундов (например, RU2110534C1, US5648419A, JPH9176364A). При сжигании силикона на воздухе или в кислороде образуется твёрдый SiO2 в виде белого порошка, который может быть использован для получения керамики.
