Фториды
Фтори́ды, химические соединения фтора с другими элементами. Известны для всех элементов, кроме гелия и неона. Выделяют простые, или бинарные, фториды (в частности, соли фтористоводородной кислоты, ковалентные фториды металлов и неметаллов, галогенфториды), оксифториды (например, POF3), гидрофториды металлов, фторсодержащие кислоты (например, фтористоводородная кислота), комплексные фториды, или фторометаллаты, например Na2NiF4, и др.
К фторидам относятся также фториды графита CFx (1 ≥ x > 0), C(MFn)x и другие, фторидные и оксифторидные бронзы (например, KxFeF3, WO3–xFx), смешанные галогениды.
Физико-химические свойства
В кристаллической структуре простых фторидов переходных металлов атомы металла, как правило, имеют октаэдрическое окружение из атомов F, причём октаэдры могут быть изолированными (MF6) либо сочленёнными.
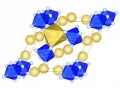 Элементарная ячейка гексафторосиликата натрия.Наиболее типичные координационные полиэдры фторометаллатов – октаэдры, которые могут быть изолированными (структура криолита, эльпасолита), иметь только мостиковые атомы F (структура перовскита, пирохлора), соединяться вершинами (структура тетрагональных и гексагональных бронз, слоистых перовскитов), рёбрами (структура рутила, Nа2SiF6 и др.), гранями (структура «гексагонального» перовскита). Образование фторометаллатов стабилизирует высшие степени окисления многих элементов, благодаря чему существуют соединения с катионами (NF4+, KrF+, XeF+5 и др.) и анионами (MnF62−, NiF62− и др.).
Элементарная ячейка гексафторосиликата натрия.Наиболее типичные координационные полиэдры фторометаллатов – октаэдры, которые могут быть изолированными (структура криолита, эльпасолита), иметь только мостиковые атомы F (структура перовскита, пирохлора), соединяться вершинами (структура тетрагональных и гексагональных бронз, слоистых перовскитов), рёбрами (структура рутила, Nа2SiF6 и др.), гранями (структура «гексагонального» перовскита). Образование фторометаллатов стабилизирует высшие степени окисления многих элементов, благодаря чему существуют соединения с катионами (NF4+, KrF+, XeF+5 и др.) и анионами (MnF62−, NiF62− и др.).
Наиболее тугоплавки и труднолетучи трифториды редкоземельных элементов, CaF2 (tкип 2530 °C), наименьшие температуры плавления и кипения у OF2 (соответственно −224 и −145 °C) и NF3 (−206,8 и −129,0 °C). Наибольшую растворимость в воде имеет SbF3 (492,4 г в 100 г H2O при 25 °C), BeF2, TlF, наименьшую – PbClF, CaF2, LaF3 и ThF4 (0,17 мг/л при 20 °C).
Многие фториды гидролизуются водой, причём склонность к гидролизу повышается в ряду от трифторидов до гептафторидов металлов и с уменьшением атомного номера металла одной подгруппы. Все фториды подвергаются пирогидролизу.
Окислительные свойства наиболее сильно выражены у фторидов неметаллов: KrF2, XeF6, галогенфториды, OF2, O2F2, NF3, N2F4, NOF3, их растворы в HF. Очень сильные окислители среди фторидов металлов: OsF7, ReF7, PtF6, PuF6, AuF5, CrF5, MnF4, CrF4, AuF3, NiF3 и др.
Получение
Способы получения фторидов основаны на взаимодействии фтора, жидкого и газообразного фтористого водорода, галогенфторидов и гидрофторида аммония с элементами (металлами и неметаллами) и другими соединениями (например, с соответствующими оксидами и гидроксидами). Фториды щёлочноземельных металлов образуются при взаимодействии их растворимых солей с плавиковой кислотой, сплавлении солей со фторидами металлов 1-й группы, сплавлении оксидов металлов с углеродом и FeF2 (карботермический способ) и др. Фториды переходных металлов получают, например, растворением их карбонатов в плавиковой кислоте с последующим пирогидролизом.
Нахождение в природе
Фториды встречаются в природе в виде минералов, среди которых наиболее распространёнными являются флюорит и криолит.
Применение
Широкое применение во многих областях промышленности находят фтористый водород, фториды кислорода, фториды азота.
В металлургии фториды используются по нескольким направлениям:
получение металлов из их фторидов: бериллия из BeF2 (магнийтермия), алюминия из расплава оксида алюминия Al2O3 в криолите Na3AlF6 (электролиз), тантала из K2TaF4 (электролиз) и др.;
извлечение металлов (Be, Sc, Th, Zr и др.) из руд в виде фторидных соединений [например, (NH4)2BeF4];
разделение металлов при их совместном присутствии в руде, основанное на разной растворимости соответствующих фторидов.
Фториды (например, ClF3 и ClF5) используются в ракетной технике как окислители ракетных топлив. В атомной промышленности находят применение гексафторид урана UF6 (для разделения изотопов урана), фторид лития LiF (материал термолюминесцентных дозиметров) и др.  Образец оптического стекла из фторида магния.Фторсодержащие материалы применяются в электронике и лазерной технике (твёрдые электролиты, катодные материалы и др.); фториды лития, магния, кальция, стронция, бария и других металлов – в качестве сырья для производства оптических стёкол; летучие фториды металлов – для нанесения металлических покрытий. В сельском хозяйстве фториды являются инсектицидами, фунгицидами, гербицидами и дефолиантами; в стоматологии – противокариесными добавками к зубным пастам (фторид натрия NaF, фторид олова SnF2 и др.).
Образец оптического стекла из фторида магния.Фторсодержащие материалы применяются в электронике и лазерной технике (твёрдые электролиты, катодные материалы и др.); фториды лития, магния, кальция, стронция, бария и других металлов – в качестве сырья для производства оптических стёкол; летучие фториды металлов – для нанесения металлических покрытий. В сельском хозяйстве фториды являются инсектицидами, фунгицидами, гербицидами и дефолиантами; в стоматологии – противокариесными добавками к зубным пастам (фторид натрия NaF, фторид олова SnF2 и др.).

