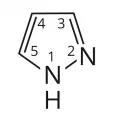
Пиразол
Пиразо́л (1H-пиразол, 1,2-диазол), пятичленное гетероароматическое соединение с двумя атомами азота в соседних положениях, C3H4N2. Относится к азолам.
Историческая справка
Немецкий химик Л. Кнорр в 1883 г. при изучении производных хинолина впервые получил феназон (2,3-диметил-1-фенил-3-пиразолин-5-он), которому дал название «антипирин», т. к. соединение обладало антипиретическим действием. Сильное болеутоляющее действие полученного соединения стимулировало развитие химии пиразола.
Э. Бухнер в 1889 г. провёл физико-химические исследования изомера глиоксалина (имидазола), которым оказался пиразол (Buchner. 1889).
Японские исследователи Косугэ Такуо (Kosuge Takuo) и Окэда Хидэо (Okeda Hideo) в 1954 г. синтезировали и исследовали биологические свойства 3-n-нонилпиразола, в результате чего была выявлена высокая противомикробная и противогрибковая активность (Kosuge. 1954).
Физико-химические свойства
Бесцветное кристаллическое вещество; молярная масса 68,08 г/моль; tпл 68 °C, tкип 187 °C. Имеет слабый запах пиридина, хорошо растворим в полярных растворителях (вода, спирты, эфиры).
Ароматичен, имеет 6π-электронную систему, по одному π-электрону от атомов углерода и атома азота в положении 2 (пиридиновый атом азота) и двух π-электронов от атома азота в положении 1 (пиррольный атом азота). Распределение электронной плотности по циклу неравномерно. Наибольшая электронная плотность сосредоточена на атоме углерода в положении 4 и атоме азота в положении 2 (пиридиновый атом азота), наименьшая – на атомах углерода в положениях 3 и 5. Наличие подвижного атома водорода NH-группы и осно́вного центра (пиридиновый атом азота) приводит к прототропной таутомерии, из-за чего положения 3 и 5 равнозначны (Yet. 2008. P. 1–141).
Амфотерен, проявляет слабые осно́вные (pKb = 2,5) и слабые кислотные (pKa = 14) свойства. Вступает в реакции с сильными основаниями (Na, KOH, NaH, трет-бутилат калия, бутиллитий) и сильными кислотами.
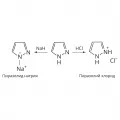 Амфотерность пиразола.Характерны реакции электрофильного замещения – сульфирование, галогенирование, протекающие по атому углерода в положении 4. Ацилирование ангидридами и хлорангидридами карбоновых кислот приводит к образованию продуктов N-замещения, которые более стабильны по сравнению с продуктами C-ацилирования.
Амфотерность пиразола.Характерны реакции электрофильного замещения – сульфирование, галогенирование, протекающие по атому углерода в положении 4. Ацилирование ангидридами и хлорангидридами карбоновых кислот приводит к образованию продуктов N-замещения, которые более стабильны по сравнению с продуктами C-ацилирования.
Гидрирование на платиновом катализаторе или восстановление натрием в спирте приводит последовательно к пиразолинам (дигидропиразолам) и пиразолидинам.
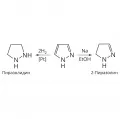 Восстановление пиразола.
Восстановление пиразола.
Получение
Пиразол мало распространён в природе, большинство его производных получено синтетическим путём.
Наиболее общий метод синтеза пиразола и его производных – реакция 1,3-дикарбонильных соединений с гидразином или его производными.
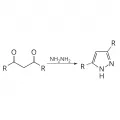 Присоединение гидразина к 1,3-дикарбонильным соединениям.Также для получения пиразола используют 1,3-диполярное присоединение ацетиленов к диазоалканам.
Присоединение гидразина к 1,3-дикарбонильным соединениям.Также для получения пиразола используют 1,3-диполярное присоединение ацетиленов к диазоалканам.
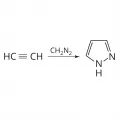 1,3-Диполярное присоединение ацетилена к диазометану.
1,3-Диполярное присоединение ацетилена к диазометану.
Применение
Благодаря высокой фармакологической активности пиразол и его производные имеют большое значение в медицинской химии. Они являются строительными блоками для создания различных лекарственных веществ, красителей, агрохимикатов и пестицидов; используются в качестве бифункциональных лигандов для получения металлических катализаторов. Как лекарственные вещества обладают противомалярийными, жаропонижающими, противоопухолевыми, противовоспалительными и антидепрессивными свойствами (Schmidt. 2011).
Продукты восстановления пиразола – пиразолины и пиразолидины – входят в состав большого количества биологически активных соединений. К лекарственным препаратам на основе пиразолина относят: феназон (антипирин), метамизол натрия (анальгин), к производным пиразолидина – фенилбутазон (бутадион).
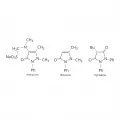 Лекарственные производные пиразола.
Лекарственные производные пиразола.