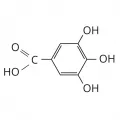
Галловая кислота
Га́лловая кислота́ (3,4,5-тригидроксибензойная кислота, 3,4,5-триоксибензойная кислота), ароматическая гидроксикарбоновая кислота, фенолкарбоновая кислота, C6H2(OH)3COOH. Соли и эфиры называются галлаты. Молярная масса 170,13 г/моль. Плотность 1,694 г/см3. tпл безводной галловой кислоты 240 °C (с разложением). Галловую кислоту открыл К. В. Шееле в 1785 г. в вытяжке из галлов на дубовых листьях.
Физико-химические свойства
Галловая кислота – бесцветное кристаллическое вещество, темнеющее на свету, хорошо растворимое в горячей воде [33 г/100 мл (100 °C)], этаноле [27,2 г/100 мл (25 °C)], растворимое в диэтиловом эфире [2,5 г/100 мл (15 °C)], холодной воде [1,16 г/100 мл (25 °C)], глицерине, ацетоне, нерастворимое в хлороформе, бензоле. Из воды кристаллизуется в виде моногидрата [tпл 220 °C (с разложением)], теряет воду при нагревании до 100–120 °C. Константы диссоциации кислоты (pKa) составляют 4,33 и 8,85.
Галловая кислота – сильный восстанавливающий агент, она восстанавливает соли золота и серебра до металлов, ионы железа (III) до ионов железа (II). С хлорным железом образует комплекс синего цвета (галловые чернила). При сухой перегонке галловая кислота декарбоксилируется с образованием пирогаллола. При нагревании с концентрированной серной кислотой даёт продукт конденсации – руфигалловую кислоту (гексагидроксиантрахинин).
Галловая кислота легко окисляется на воздухе, особенно в виде растворов солей щелочных металлов. Мышьяковая кислота, перманганат калия, персульфат, иод окисляют галловую кислоту в эллаговую кислоту.
При гидрировании на родий-алюминиевом катализаторе галловая кислота превращается в гексагидрогалловую кислоту.
Галловая кислота образует межмолекулярные сложные эфиры (депсиды), такие как метадигалловая, метатригалловая кислоты и циклические эфиры (депсидоны).
Способы получения
Галловую кислоту получают щелочным, кислотным или ферментативным гидролизом таннинов.
Участие в обмене веществ
У растений и бактерий галловая кислота синтезируется из 3-дегидропроизводного шикимата под действием мультифункционального фермента шикиматдегидрогеназы (КФ 1.1.1.25) через образование промежуточного соединения 3,5-дидегидропроизводного шикимата, которое подвергается спонтанной ароматизации. При взаимодействии галловой кислоты с уридиндифосфатглюкозой образуется сложный эфир β-глюкогаллин, который в результате серии последовательных реакций галлоилирования превращается в пента-О-галлоилглюкозу, ключевой интермедиат при биосинтезе галло- и эллаготаннинов.
В некоторых растениях галловая кислота содержится в свободном состоянии, например в сумахе, листьях чая, дубовой коре, корнях гранатового дерева, листьях винограда.
Сложные эфиры галловой кислоты с многоатомными спиртами, например глюкозой, образуют гидролизуемые таннины. Галлотаннины накапливаются в растениях в значительных количествах; так, галлы сумаха китайского могут содержать до 70 % таннинов (от веса сухого вещества).
Применение
Галловая кислота используется для получения пирогаллола, синтеза красителей и лекарственных препаратов. Субгаллат висмута используется как вяжущее, подсушивающее и противовоспалительное средство. Эфиры галловой кислоты применяют в качестве антиоксидантов в пищевой промышленности.
Содержание в продуктах питания
Содержание галловой кислоты в продуктах питания
№ п/п | Растение, продукт | Содержание |
1 | Чай чёрный, лист – на сырой вес | 3,5 г/кг |
2 | Чай чёрный, напиток | 24 мг/л |
3 | Чай зелёный, лист – на сухой вес | 2,3–5,2 г/кг |
4 | Вина французские | 31–38 мг/л |
5 | Вина калифорнийские красные (белые) | 65–126 (16–46) мг/л |
6 | Пиво немецкое Rauchbier | 3,5 мг/л |
7 | Ягоды:
|
8–67 мг/кг 19–38 мг/кг 11–44 мг/кг 30–62 мг/кг 3–38 мг/кг |