Вирус гепатита D
Ви́рус гепати́та D, вирус гепатита дельта (Deltavirus italiense, Hepatitis delta virus, HDV), вид вирусов рода Deltavirus, семейство Kolmioviridae. Оболочечный РНК-содержащий вирус-сателлит вируса гепатита В; возбудитель вирусного гепатита D. Дефектные частицы вируса гепатита D от хелперного вируса гепатита В получают суперкапсид, компоненты которого необходимы для сборки, высвобождения и распространения вирусной частицы, однако не участвуют в процессе репликации вируса-сателлита. Заражение вирусом гепатита D возможно путём коинфекции (в случае одновременной инфекции с вирусом гепатита B) либо путём суперинфекции (когда вирус гепатита дельта приобретается со временем и накладывается на существующую в организме инфекцию, вызванную вирусом гепатита В).
История открытия вируса
В середине 1970-х гг. М. Риццетто, гастроэнтеролог, в Турине (Италия) обнаружил не выявленный ранее ядерный антиген в гепатоцитах пациентов с хронической формой гепатита В. Изначально его истолковали как новый гепатит В-специфичный антиген и назвали дельта-антигеном (HDAg). Высокий показатель распространённости наблюдался у больных гемофилией и наркозависимых людей, особенно на юге Италии. В начале 1980-х гг. было показано, что HDAg и молекула РНК малого размера являются внутренним содержимым вирусоподобных частиц, покрытых оболочкой, содержащей поверхностный антиген вируса гепатита В (HbsAg). Было установлено, что вирусоподобный дельта-антиген ассоциирован с наиболее тяжёлыми формами острого или хронического гепатита В; стало понятно, что патоген является дефектным, и для его репликации необходимо, чтобы клетки были заражены вирусом гепатита В. Таким образом, в некоторых случаях тяжёлое течение гепатита В было результатом сопутствующей инфекции дельта-антигеном. Уже в 1983 г. дельта-агент рассматривался как уникальный и важный с медицинской точки зрения для того, чтобы выделить его в отдельный вирус гепатита D и соответствующее заболевание именовать гепатитом D. В 1986 г. клонирование и секвенирование генома дельта-вируса подтвердило его уникальность среди других вирусов животных. Вирус гепатита D, или дельта-вирус, является единственным представителем рода Deltavirus.
Структура вируса и строение генома
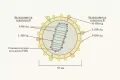
Вирион вируса гепатита D сферической формы диаметром 36–43 нм имеет суперкапсид – фосфолипидную мембрану со встроенными молекулами поверхностного антигена S (HBsAg) вируса гепатита В. Под суперкапсидом располагается рибонуклеопротеиновый комплекс диаметром 19 нм, который состоит из одной молекулы геномной РНК в комплексе с молекулами дельта-антигена HDAg (70–220 копий белка на вирион). Несмотря на то что вирус гепатита D содержит геномную РНК и множественные копии дельта-антигена HDAg внутри вириона, нет доказательств организации структуры РНК и белковой оболочки в специфический нуклеокапсид. Наоборот, РНК может обвивать мультимеры дельта-антигена HDAg.
Геном вируса представляет собой кольцевую одноцепочечную молекулу РНК отрицательной полярности длиной около 1,7 кб. Геномная РНК формирует неразветвленную стержневидную структуру, включающую 74 % спаренных оснований. И геном, и антигеном вируса гепатита D содержат рибозим. В отличие от других вирусов животных, геном которых представлен молекулой РНК отрицательной полярности, вирус гепатита D не кодирует свою РНК-полимеразу и в процессе репликации использует исключительно транскрипционный аппарат клетки.
Суперкапсид включает в себя три белка оболочки вируса гепатита В: S-HBsAg, M-HBsAg и L-HBsAg. Соотношение форм поверхностного антигена HBsAg S:M:L = 95:5:1, распределение более похоже на то, которое встречается в пустых дефектных 22 нм-частицах, нежели в частицах Дейна. Известно, что S-HBsAg достаточен для сборки вирусной частицы; L-HBsAg необходим для того, чтобы вирион был инфекционным; М-HBsAg не является необходимым ни для сборки, ни для инфекционной способности вириона.
В геноме вируса гепатита D закодирован единственный структурный белок – дельта-антиген HDAg, который представлен двумя изоформами – большой (L-HDAg) и малой (S-HDAg), каждой из который отведена своя специфическая роль в жизненном цикле вируса. Малая изоформа необходима для инициации вирусной репликации, в то время как большая необходима для сборки вирусной частицы и ингибирования репликации. Предполагается, что S-HDAg участвует в перенацеливании клеточной РНК-полимеразы с ДНК на РНК-субстрат. Большая изоформа L-HDAg содержит мотив изопренилирования на С-конце (т. н. CXXX-box, где С – остаток цистеина, по которому происходит прикрепление изопреноидных групп), который необходим для заякоривания рибонуклеопротеина вируса гепатита D с белком HBsAg в процессе сборки вириона. Большая изоформа L-HDAg появляется не сразу и является результатом процесса редактирования геномной РНК, осуществляемого клеточным ферментом аденозиндезаминазой (ADAR1).
Редактирование геномной РНК
При редактировании антигеномной молекулы РНК происходит замена аденозина на инозин в 1015-й позиции (замена стоп-кодона UAG на UIG). При синтезе новой геномной молекулы РНК на матрице отредактированного антигенома в данной позиции появляется цитозин (кодону UIG антигенома соответствует кодон ACC генома). Когда такой модифицированный геном транскрибируется в мРНК, чтобы синтезировать дельта-антиген, исходный стоп-кодон UAG заменяется на UGG, который соответствует триптофану. Синтез L-HDAg продолжается вплоть до следующего стоп-кодона, который находится на 19 кодонов ниже: таким образом, большая изоформа HDAg длиннее малой на 19 аминокислотных остатков.
Модификации дельта-антигена
Модификации дельта-антигена на посттрансляционном уровне, необходимые для регуляции жизненного цикла вируса гепатита D: фосфорилирование, ацетилирование, метилирование, пренилирование.
Обе формы дельта-антигена HDAg фосфорилированы, хотя уровень фосфорилирования большой изоформы в 6 раз выше. Фосфорилирование короткой формы дельта-антигена происходит по остаткам серина и треонина, в то время как фосфорилирование длинной изоформы – только по остаткам серина. Главный сайт фосфорилирования – 177-й остаток серина. Фосфорилирование, метилирование и ацетилирование дельта-антигена важно для репликации вирусной РНК.
Пренилирование большой изоформы дельта-антигена является необходимым условием для взаимодействия между L-HDAg и белками оболочки вируса гепатита В.
Жизненный цикл вируса
Единственными природно чувствительными клетками к вирусу гепатита D, как и к вирусу гепатита B, являются гепатоциты. Оба вируса для проникновения в клетку используют длинную форму HBs-антигена вируса гепатита В (L-HBsAg).
Прикрепление вируса к клетке происходит через поверхностные гепарансульфат-протеогликаны (HSPGs) гепатоцитов, при этом непосредственное проникновение вируса происходит очень медленно: спустя 3 часа после прикрепления вируса к первичным гепатоцитам 50 % вирионов остаются адсорбированными на клеточной поверхности и являются чувствительными к ингибиторам, блокирующим участок L-HBsAg, ответственный за инфекционность вирусной частицы. Рецептором для вирусов гепатитов В и D является белок – транспортёр жёлчных кислот NTCP (sodium taurocholate co-transporting peptide, натрий-таурохолат котранспортирующий полипептид).
После взаимодействия с рецептором проникновение вируса в клетку происходит путём клатрин-зависимого эндоцитоза. Дельта-антиген HDAg определяют как клатрин-адапторный белок, который специфично взаимодействует с тяжёлой цепью клатрина. В отличие от вируса гепатита В, сборка вируса гепатита D ослабевает после подавления тяжёлой цепи клатрина. Это свидетельствует о том, что, несмотря на общие белки оболочки, механизмы сборки и высвобождения вирусных частиц гепатитов В и D происходят разными путями. Эффективность сборки вирусных частиц различается между генотипами вируса гепатита D, коррелируя со способностью дельта-антигена взаимодействовать с тяжёлой цепью клатрина.
После проникновения вируса в клетку рибонуклеопротеиновый комплекс транспортируется в ядро, где происходит репликация вирусного генома без участия компонентов вируса гепатита В и без каких-либо ДНК-интермедиатов. Репликация происходит по типу двойного катящегося кольца – механизму предполагаемой репликации для вироидов растений. Синтез антигеномной РНК осуществляется клеточной РНК-полимеразой на длину более одного генома, после чего благодаря аутокаталитическому расщеплению (разрезанию) по сайту антигеномного рибозима происходит отделение одной молекулы антигенома. Последующее сворачивание антигеномной РНК в стержневидную структуру, сшивание (лигирование) концов молекулы клеточными лигазами ведёт к формированию кольцевой матрицы для синтеза геномной РНК, происходящему по тому же механизму; затем геномная РНК включается в новые вирусные частицы или используется снова в качестве матрицы для синтеза антигеномной РНК. Соотношение между геномной и антигеномной РНК в клетке ассиметрично: геномной в 15 раз больше, чем антигеномной. При синтезе антигенома и мРНК дельта-антигена в качестве матрицы выступает геномная РНК вируса, тем не менее транскрипция этих элементов начинается с разных сайтов инициации, с использованием разных ферментов (предполагается, что синтез антигенома происходит РНК-полимеразой 1, а синтез мРНК – РНК-полимеразой 2) и в различных субкомпартментах: синтез антигенома осуществляется в ядрышке, в то время как мРНК транскрибируется в нуклеоплазме, как и геном. Синтезированные молекулы мРНК транспортируются в цитоплазму, где происходят синтез дельта-антигена и последующее формирование рибонуклеопротеинового комплекса. Завершается формирование вирусной частицы путём приобретения суперкапсида на мембранах аппарата Гольджи. В отличие от вируса гепатита В вирионы вируса гепатита D покидают клетку в секреторных везикулах.
Так как репликация вируса гепатита В сильно подавлена в присутствии вируса гепатита D, считается, что повреждения печени в большей степени вызваны инфекцией вирусом гепатита D, нежели вирусом гепатита В. Гистологически наблюдаются обширное воспаление и некроз печени. In vivo выражается в наличии пула клеток воспаления вокруг инфицированных гепатоцитов, в присутствии различных аутоимунных антител в сыворотке крови пациентов, свидетельствующих об иммуно-опосредованном повреждении печени.
Устойчивость вируса к внешним воздействиям
Вирус гепатита D устойчив к высоким и низким температурам, ультрафиолету и химическим воздействиям. Инактивировать вирус можно только концентрированными щелочными растворами и дезинфицирующими составами на основе протеаз.
Распространение вируса в природе
Естественным хозяином вируса гепатита D является человек; чувствительны к этому вирусу также шимпанзе, инфицированные вирусом гепатита В, и сурки, инфицированные вирусом гепатита сурков. Путь передачи вируса – парентеральный. В индустриальных странах группы с высоким риском – это наркозависимые люди, а также люди, которые подвержены частым переливаниям крови. Считается, что путь передачи через половые контакты нетипичен для вируса гепатита D (соответствующий статистический процент передач значительно ниже, чем у вируса гепатита В и ВИЧ). Однако на Тайване это основной путь передачи вируса. Перинатальный способ передачи вируса гепатита D встречается редко.
Вакцинация от вируса гепатита В автоматически защищает от инфицирования вирусом гепатита D.
Роль вируса гепатита D в канцерогенезе
Несмотря на то что вирус гепатита D не включён в список онкогенных вирусов, по результатам метаанализа хронический гепатит D ассоциирован с повышенным – в сравнении с моноинфекцией вирусом гепатита В – риском развития гепатоцеллюлярной карциномы; однако не до конца ясны молекулярные механизмы, по которым происходит возникновение рака печени. Потенциальные механизмы канцерогенеза, опосредованного дельта-антигеном вируса гепатита D, включают активацию TGF-β (Transforming growth factor β) \ c-Jun сигнального пути. Также есть свидетельства, что L-HDAg индуцирует окислительный стресс через активацию гена Nox4, который увеличивает высвобождение и генерацию активных форм кислорода (АФК), что в итоге приводит к активации транскрипционных факторов STAT3 и NF-kB, участвующих в процессах воспаления, апоптоза, пролиферации клеток и канцерогенеза. Ряд исследований подтверждают, что во многих человеческих опухолях поддерживается конститутивная активация транскрипционного фактора STAT3, которая опосредует клеточную трансформацию, действуя как онкоген. Таким образом, активация STAT3 также является одним из возможных механизмов, обусловливающих вирус гепатита D-опосредованный канцерогенез. В некоторых работах инфекция вирусом гепатита D приводит к гиперметилированию промоторных областей генов, которые способствуют подавлению генов опухолевых супрессоров и регуляторов клеточного цикла.