Вирус гепатита B
Ви́рус гепати́та B (Hepatitis B virus, HBV), вид вирусов рода Orthohepadnavirus семейства гепаднавирусов. Является возбудителем вирусного гепатита B.
Изучение вируса гепатита B началось с исследований американского учёного Б. С. Бламберга, который в 1963 г. обнаружил в сыворотке крови австралийских аборигенов необычные белковые вирусоподобные частицы (сферические диаметром 22 нм и палочковидные размерами 22нм*50–230 нм), названные позднее «австралийским антигеном». Эти вирусоподобные частицы не проявляли инфекционных свойств. Позднее было установлено, что «австралийский антиген» представляет собой поверхностный антиген вируса гепатита В (HBsAg – Hepatitis B surface antigen), который во время репродукции вируса образуется в большом количестве и поступает в кровь в виде дефектных вирусоподобных частиц. В 1970 г. британским учёным Д. Дейном в сыворотке людей с посттрансфузионным гепатитом были обнаружены крупные сферические частицы диаметром 42 нм, которые впоследствии были названы «частицами Дейна», именно они представляют собой инфекционные вирионы вируса гепатита В. В 1976 г. Б. С. Бламберг получил Нобелевскую премию по физиологии и медицине с формулировкой «За открытия, касающиеся новых механизмов происхождения и распространения инфекционных заболеваний» (The Nobel Prize in Physiology or Medicine 1976 // The Nobel Prize). Именно Бламбергом была предложена идея получения первых плазменных вакцин против вируса гепатита В.
Структура вируса и строение генома
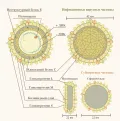
Вирус гепатита B относится к оболочечным ДНК-содержащим вирусам. Вирион сферической формы диаметром 42 нм имеет суперкапсид – фосфолипидную мембрану с встроенными молекулами поверхностного антигена S (HBsAg). Тип симметрии суперкапсида – икосаэдрический. Под суперкапсидом располагается сердцевина вируса диаметром 27 нм, представленная капсидным белком С (HBсAg). Под сердцевиной располагаются геномная ДНК, ковалентно связанная с вирусной ДНК-полимеразой, и белок капсида HB-e-антиген (HBeAg).
Геном вируса представляет собой релаксированную кольцевую молекулу двухцепочечной ДНК длиной около 3,2 кб. При этом плюс-цепь ДНК является недостроенной и составляет 2/3 длины полноразмерной минус-цепи ДНК. У небольшой фракции вируса (5–20 %) геном представлен линейной молекулой ДНК. Вирионы с линейной ДНК инфекционны, но могут утратить важную часть последовательности ДНК в процессе инициации инфекции и, как следствие, принимать минимальное участие в последующей репликации вируса.
В геноме вируса гепатита B содержится информация о 4 вирусных генах: S, C, P, X, однако наличие перекрывающихся рамок считывания приводит к синтезу 7 вирусных белков. С 5’-концом минус-цепи ДНК ковалентно связана вирусная полимераза, которая состоит из трёх функциональных доменов: TP (terminal protein) – домен, необходимый для начала синтеза минус-цепи ДНК, RT (reverse transcriptase) – домен, благодаря которому осуществляется процесс обратной транскрипции, RNaseH – домен, благодаря которому фермент обладает активностью РНКазы. Вирусная полимераза является продуктом гена Р.
В гене S закодированы 3 интегральных трансмембранных гликопротеина вирусной оболочки с различными N-концами за счет трёх различных открытых рамок считывания. Поверхностные гликопротеины суперкапсида представлены длинной, средней и малой формами, которые называются соответственно L-HBsAg(Large), M-HBsAg (Medium), S-HBsAg (Small). В вирусной оболочке частиц Дейна L-, M-, S-белки представлены в соотношении 1:1:4. Самый короткий (S-белок) является наиболее представленным гликопротеином оболочки вируса и субвирусных сферических и палочковидных структур. Специфическая функция М-белка пока до конца неясна, но он не является необходимым для сборки вирусной частицы. L-белок отвечает за прикрепление вируса к рецептору клетки, а также играет определяющую роль наряду с S-белком в формировании вириона вируса гепатита В.
С-белок (HBcAg) формирует капсид вируса. Небольшое количество С-белка представлено также на поверхности гепатоцита, где он выступает в качестве рецептора для цитотоксических Т-лимфоцитов. Наличие двух промоторных областей в гене С приводит к синтезу Е-белка (HBеAg), который активно секретируется в кровь. Е-белок считается неструктурным, и предполагается, что благодаря наличию одинаковых последовательностей с С-белком он также способен взаимодействовать с цитотоксическими Т-лимфоцитами, при этом блокируя их взаимодействие с инфицированным гепатоцитом. При таком ингибировании Т-киллеров и подавлении цитолиза инфицированных гепатоцитов затрудняется элиминация вируса и развивается хроническая инфекция. Предполагается, что Е-белок принимает участие также в формировании капсида.
Самый маленький ген, обнаруженный исключительно у гепаднавирусов млекопитающих, кодирует Х-белок (17кДа) – цитоплазматический белок с периодом полужизни 15–20 минут. Но часть фракции Х-белка также ассоциирована с цитоскелетом и с ядром клетки. Несмотря на то что Х-белок необходим для эффективной инфекции и репликации in vivo, его роль в жизненном цикле вируса пока неясна. По биологическим свойствам Х-белок обладает трансактиваторной функцией и вызывает нарушение клеточной регуляции подобно Е6-белку папилломавирусов человека, большого Т-антигена вируса SV40 и E1B-белку аденовирусов, т. е. тех ДНК-вирусов, которые вызывают развитие опухолей.
Жизненный цикл вируса
Рецептором для вируса гепатита В является белок – транспортёр жёлчных кислот NTCP (sodium taurocholate co-transporting polypeptide, натрий-таурохолат котранспортирующий полипептид), экспрессируемый на мембране гепатоцитов. При взаимодействии NTCP с N-концом белка L-HBsAg происходит проникновение вируса в клетку путём клатрин-зависимого эндоцитоза, после чего вирусная ДНК транспортируется в ядро клетки. С помощью вирусной ДНК-полимеразы происходит достраивание плюс-цепи вирусной ДНК, в результате чего релаксированная кольцевая ДНК переходит в ковалентно связанную кольцевую форму ДНК, которая служит матрицей для синтеза прегеномной вирусной РНК (пгРНК) и РНК-транскриптов вирусных генов. Синтезированные клеточной РНК-полимеразой молекулы пгРНК и транскрипты вирусных генов транспортируются в цитоплазму клетки, где происходит трансляция вирусных белков, а также сборка капсидов вокруг молекул пгРНК. В процессе сборки капсидов с помощью вирусной ДНК-полимеразы происходит обратная транскрипция на матрице пгРНК с образованием минус-цепи ДНК, которая в дальнейшем служит матрицей для синтеза укороченной плюс-цепи ДНК. Суперкапсидную оболочку дочерние вирионы получают на мембранах ЭПС, а затем покидают инфицированную клетку в секретирующих мультивезикулярных тельцах.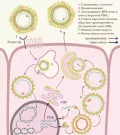 Жизненный цикл вируса гепатита B (Hepatitis B virus).Кроме продуктивной инфекции, описанной в жизненном цикле вируса, возможно протекание интегративной инфекции, когда ДНК вируса встраивается в геном гепатоцита. Интегративную инфекцию рассматривают как одну из причин возникновения гепатоцеллюлярной карциномы у людей с хронической формой гепатита В.
Жизненный цикл вируса гепатита B (Hepatitis B virus).Кроме продуктивной инфекции, описанной в жизненном цикле вируса, возможно протекание интегративной инфекции, когда ДНК вируса встраивается в геном гепатоцита. Интегративную инфекцию рассматривают как одну из причин возникновения гепатоцеллюлярной карциномы у людей с хронической формой гепатита В.
Гепатоциты – единственный тип клеток, которые достоверно реплицируют вирус, несмотря на его обнаружение и в других тканях организма. Доказано, что вирусы гепатита В и гепатита С являются основной причиной возникновения гепатоцеллюлярной карциномы (более 80 % всех случаев первичного рака печени).
Устойчивость вируса к внешним воздействиям
Вирус гепатита B высокоустойчив к различным физическим и химическим факторам: низким и высоким температурам (вирус сохраняет жизнеспособность при комнатной температуре в течение нескольких месяцев, в замороженном виде – в течение 15–20 лет), многократному замораживанию и оттаиванию, длительному воздействию кислой среды, УФ-облучению, обработке 80 %-ным этанолом. Инактивируется вирус при кипячении в течение более 30 минут, стерилизации сухим жаром 160 °C – не менее 2 ч.
Распространение вируса в природе. Вакцины
Передача инфекции может происходить перинатальным (от матери к ребёнку), половым, парентеральным (через кровь и другие биологические жидкости) и бытовым (через бритву, маникюрные принадлежности, зубные щётки) путём. Титр вируса гепатита В может достигать 1010 частиц Дейна в 1 мл крови, при этом субвирусных частиц синтезируется, как правило, на два порядка больше. Предполагается, что за счёт такого механизма вирусу удается долго скрываться от иммунной системы.
Первые вакцины получали от больных с хроническим течением инфекции: из плазмы крови очищали вирусоподобные частицы – «австралийский антиген» – и использовали его в качестве вакцины. На смену таким плазменным вакцинам пришли вакцины, полученные генно-инженерным способом, основным компонентом которых также является поверхностный антиген HBsAg, но которые обладают рядом преимуществ, в том числе и безопасностью применения.