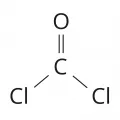
Фосген
Фосге́н (карбонилхлорид, дихлорангидрид угольной кислоты), бесцветный газ с запахом прелого сена или гниющих фруктов, COCl2. tпл –118 ℃, tкип 7,56 ℃; плохо растворим в воде (0,9 % по массе при 20 ℃), хорошо – в органических растворителях.
Фосген обладает свойствами галогенангидридов карбоновых кислот. Влагой воздуха газообразный фосген гидролизуется медленно, в жидкой фазе гидролиз происходит быстро, в присутствии щелочей – моментально. С аммиаком образует мочевину и хлорид аммония; с аминами, в зависимости от условий, алкил(арил)замещённые мочевины или изоцианаты (с избытком фосгена при нагревании):
Взаимодействие фосгена со спиртами приводит к хлоркарбонатам ClCOOR и карбонатам ROCOOR; с солями карбоновых кислот – к соответствующим ангидридам; с оксидами металлов (при нагревании) – к галогенидам металлов, например: . При поликонденсации фосгена с двухатомными фенолами образуются поликарбонаты, например:
Фосген вступает в реакцию Фриделя – Крафтса, например с третичными ароматическими аминами образует аминозамещённые диарилкетоны, используемые в синтезе красителей:
Основной способ получения фосгена – хлорирование СО на активированном угле при 125–150 ℃; образуется также при окислении полихлорсодержащих углеводородов.
Для качественного и количественного анализа фосгена используют его реакцию с анилином с образованием N,N'-дифенилмочевины CO(NHC6H5)2 или реакцию с п-фенетидином H2NC6H4OC2H5 с образованием N,N'-(4,4'-диэтоксидифенил)мочевины CO(NHC6H4OC2H5)2.
Фосген – важный промышленный продукт, применяется как сырьё в производстве красителей, поликарбонатов, мочевины и её производных, изоцианатов, безводных хлоридов металлов, пестицидов, лекарственных средств, растворителей.
Отравляющее вещество удушающего действия, использовался в Первую мировую войну. Смертельная концентрация 3,2 мг/л при экспозиции 1 мин. Вызывает отёк лёгких, раздражение глаз и слизистых оболочек. Скрытый период действия 2–12 ч. Обладает кумулятивными свойствами. Защита от фосгена – противогаз.