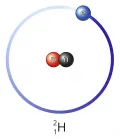
Дейтерий
Дейте́рий (от греч. δεύτερος – второй, лат. Deuterium), тяжёлый водород, D или 2Н, стабильный изотоп водорода с массовым числом 2; атомная масса 2,014101779. Содержание в природном водороде 0,015 %. Ядро атома дейтерия – дейтрон – состоит из одного протона и одного нейтрона. Дейтерий открыт спектральным методом Г. Юри с сотрудниками в 1932 г.
Молекула двухатомна. По аналогии с водородом существуют орто- и парадейтерий, различающиеся по магнитным, оптическим и термическим свойствам и содержащиеся обычно в соотношении 2:1. Большое различие масс дейтерия и водорода обусловливает различие их свойств (изотопные эффекты). Межъядерное расстояние в молекуле D2 74 пм, энергия диссоциации 439,68 кДж/моль (0 К); tпл –254,5 °C, tкип –249,43 °C. По химическим свойствам дейтерий аналогичен водороду, однако скорость реакций при замене атомов Н на атомы D уменьшается в 5–10 раз. Дейтерий образует соединения со многими элементами; с кислородом образует тяжёлую воду D2O. Дейтериды – соединения, аналогичные гидридам. Дейтерий выделяют из тяжёлой воды (например, электролизом, реакцией с металлами) или ректификацией водорода. Применяют дейтерий в качестве замедлителя нейтронов в ядерных реакторах (в виде D2O), как изотопный индикатор в научных исследованиях; дейтерид лития 6LiD – основной компонент заряда термоядерного оружия.