Осмос
О́смос (от греч. ὠσμός – толчок, давление), самопроизвольный перенос растворителя через полупроницаемую мембрану, не пропускающую растворённое вещество и разделяющую два раствора различной концентрации или чистый растворитель и раствор. Явление открыто французским естествоиспытателем Ж. А. Нолле в 1748 г.; измерение осмотического давления впервые произвёл В. Пфеффер в 1877 г.
Описание процесса осмоса
Самопроизвольный массоперенос растворителя из области I в область II возникает вследствие неравенства химических потенциалов растворителя и в этих областях. Для идеальных или бесконечно разбавленных растворов при постоянной температуре и , где и – химический потенциал и давление насыщенного пара чистого растворителя, – парциальное давление в области II, – абсолютная температура, – газовая постоянная. Так как , то , что определяет перенос растворителя через мембрану. Избыточное гидростатическое давление, возникающее в области II, препятствует диффузии растворителя, в результате устанавливается равновесие. Величина осмотического давления принимается равной равновесному гидростатическому давлению столба жидкости в капилляре, находящемуся в области II.
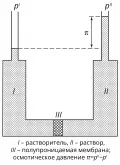 Осмотическое равновесие в растворах.Значение можно определить и как давление, которое надо приложить к раствору, чтобы прекратить перенос растворителя. Зависимость осмотического давления от состава для идеальных растворов описывают уравнением ван Лаара: или , где – мольный объём чистого растворителя, – его мольная доля. Из уравнения следует, что осмотическое давление пропорционально . Этой же величине пропорциональны понижение температуры замерзания и повышение температуры кипения идеальных растворов по сравнению с чистым растворителем. Перечисленные свойства растворов, содержащих нелетучие растворённые вещества, называются коллигативными. Они зависят от природы растворителя и концентрации растворённого вещества и не зависят от свойств частиц.
Осмотическое равновесие в растворах.Значение можно определить и как давление, которое надо приложить к раствору, чтобы прекратить перенос растворителя. Зависимость осмотического давления от состава для идеальных растворов описывают уравнением ван Лаара: или , где – мольный объём чистого растворителя, – его мольная доля. Из уравнения следует, что осмотическое давление пропорционально . Этой же величине пропорциональны понижение температуры замерзания и повышение температуры кипения идеальных растворов по сравнению с чистым растворителем. Перечисленные свойства растворов, содержащих нелетучие растворённые вещества, называются коллигативными. Они зависят от природы растворителя и концентрации растворённого вещества и не зависят от свойств частиц.
Зависимость осмотического давления от молярной концентрации растворённого вещества , когда она мала, выражается законом Вант-Гоффа: (открыт в 1887). Уравнение аналогично уравнению состояния идеального газа, но это сходство не имеет обоснования, оно случайно. Для разбавленных растворов электролитов уравнение Вант-Гоффа имеет вид: , где , – степень диссоциации электролита, – число ионов, на которые распадается молекула электролита. В случае сильных электролитов, полностью диссоциирующих на ионы, при высоких разбавлениях , а для раствора произвольной концентрации , где – практический осмотический коэффициент, непосредственно связанный с активностью растворённого вещества.
Наиболее существенная черта всех осмотических процессов – увеличение объёма раствора. Оно всегда имеет место, если молекулы растворённого вещества не могут выйти из раствора, а растворитель способен проникать в раствор. Это условие может выполняться даже при отсутствии видимой полупроницаемой перегородки. Например, если две фазы содержат нелетучий компонент и не разделены перегородкой, а находятся под общим колпаком, из-под которого откачан воздух, то за счёт разности давлений насыщенного пара произойдёт «перекачка» растворителя из раствора меньшей концентрации в раствор большей концентрации нелетучего компонента. Такой процесс называют «изотермической перегонкой».
Если давление над раствором в области II с помощью нагнетательного насоса повысить выше осмотического, то равновесие нарушится и будет происходить перенос растворителя из более концентрированного раствора в менее концентрированный (или в чистый растворитель). Это явление называют обратным осмосом. Обратный осмос широко используют для деминерализации, т. е. снижения в воде общего солесодержания или удаления из неё каких-либо ионов. Деминерализация, направленная на получение питьевой воды, называется опреснением. Если солевой состав не отвечает нужным требованиям, он может быть скорректирован добавкой необходимых компонентов.
Доля установок обратного осмоса на рынке различных технологий опреснения воды самая высокая (42 %). Наиболее крупные установки производительностью 1130 и 5680 м3/ч расположены в Санта-Барбаре (США) и в Сингапуре; стоимость 1 м3 опреснённой воды соответственно составляет 2 и 0,48 долл. США.
Осмотическое давление измеряют в статических или динамических осмометрах. В статических осмометрах осмотическое давление определяют непосредственно по высоте столба жидкости, которая устанавливается в результате проникновения растворителя через мембрану в раствор. В динамических осмометрах находят зависимость скорости переноса растворителя через мембрану от перепада давления по обе её стороны (т. н. противодавление ). Скорость движения растворителя становится равной нулю при . Путём экстраполяции противодавления до нулевой скорости определяют осмотическое давление. Осмотическое давление учитывают при расчётах аппаратов обратного осмоса.
Осмос используют при определении молекулярной массы полимеров. Мольно-объёмную концентрацию в уравнении Вант-Гоффа можно представить в виде: , где – молекулярная масса полимера, – масса полимера в единице объёма раствора. Тогда уравнение Вант-Гоффа будет выглядеть следующим образом: . Согласно теории Флори – Хаггинса с учётом неидеальности , где – коэффициент, учитывающий взаимодействие молекул. Для определения молекулярной массы измеряют осмотическое давление ряда разбавленных растворов с разной концентрацией исследуемого полимера в одном и том же растворителе и экстраполируют зависимость до значения . Поскольку полимеры полидисперсны, то найденная молекулярная масса является усреднённой по числу молекул. Диапазон измеряемых с помощью осмоса молекулярных масс составляет 103–106.
Роль осмоса в биологических процессах
Животные и растительные клетки представляют собой микроскопические осмотические системы, поскольку у клетки оболочка и прилегающая к ней плазмалемма обладают свойствами полупроницаемых мембран. Солевой состав биологических жидкостей и клеток, характерный для каждого вида организмов, поддерживается избирательной проницаемостью мембран и активным транспортом ионов. Относительное постоянство осмотического давления обеспечивается водно-солевым обменом. Если поместить клетки в дистиллированную воду, происходит набухание, а затем разрыв оболочек (осмотический шок или лизис). В растворах с высокой концентрацией солей наблюдается падение осмотического давления и коллапс клеток из-за потери воды (плазмолиз). Это явление используют, например, при консервировании пищевых продуктов путём добавления больших количеств соли или сахара: микроорганизмы подвергаются плазмолизу и становятся нежизнеспособными.
Растворы с одинаковым значением осмотического давления называются изотоническими. Растворы с осмотическим давлением бóльшим, чем у внутриклеточной жидкости, называются гипертоническими, с меньшим – гипотоническими. Один и тот же раствор для одного типа клеток может быть гипертоническим, для другого – изотоническим, для третьего – гипотоническим.
В тканях растений осмотическое давление составляет 0,5–2,0 МПа, у растений в пустынях – более 10 МПа. Гидростатическое давление, возникшее во внутриклеточных структурах в результате осмоса, называется тургором. Это давление придаёт прочность и упругость тканям живых организмов. Если клетка отмирает, оболочка теряет свойство полупроницаемости, тургор исчезает (растение вянет). Осмотическое давление – главная причина, обеспечивающая движение воды в растениях и её подъём от корней до вершины. Для роста и развития растений важно соотношение между осмотическим давлением почвенного раствора и клеточного сока. Растение может нормально развиваться лишь тогда, когда осмотическое давление клеточного сока больше осмотического давления почвенного раствора.
Высокоорганизованные животные и человек отличаются относительным постоянством осмотического давления; например, в крови человека осмотическое давление составляет 0,78 МПа (7,7 атм) при 37 °С. Даже небольшое изменение осмотического давления вызывает чувство дискомфорта. Так, чувство жажды обусловлено потребностью организма восстановить нормальное осмотическое давление введением воды после того, как оно было повышено, например, употреблением солёной пищи. При болезненных явлениях локальные изменения осмотического давления могут быть значительными. Например, при воспалительных процессах происходит распад белков, что приводит к увеличению количества структурных частиц в очаге воспаления, повышению осмотического давления и локальному оттоку воды из окружающих тканей. Так возникают отёки. В медицине обычно используют изотонические растворы, но иногда применяют и гипертонические. Так, в хирургии гипертоническими повязками покрывают раны. Повязка оттягивает на себя жидкость и очищает рану от микроорганизмов и продуктов распада тканей.