Инсулин
Инсули́н, белковый гормон животных и человека; один из самых важных регуляторов обменных процессов. Впервые выделен канадскими учёными Ф. Г. Бантингом и Ч. Г. Бестом в 1921–1922 гг. Инсулин – первый белок, для которого была установлена полная аминокислотная последовательность (Ф. Сенгер, 1953).
Молекула инсулина состоит из двух пептидных цепей, содержащих 21 (цепь A) и 30 (цепь B) аминокислотных остатков и соединённых двумя дисульфидными мостиками (-S-S-); молекулярная масса около 6000.
Инсулин обнаружен у представителей всех классов позвоночных (их инсулины отличаются положением отдельных аминокислот). Кроме того, инсулин (или инсулиноподобный гормон) имеется у многих беспозвоночных. У большинства позвоночных гормон кодируется одним геном. Только у некоторых рыб, а также у мышей и крыс два разных гена кодируют два вида инсулина, различающихся несколькими аминокислотными остатками.
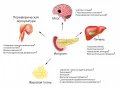
Синтез и секреция инсулина
У большинства позвоночных инсулин синтезируется бета-клетками островков Лангерганса поджелудочной железы (отсюда название: от лат. insula – остров) в виде неактивного предшественника – проинсулина, а после его частичного протеолитического гидролиза («вырезание» фрагмента в середине пептидной цепи) образуется активный гормон, который секретируется в кровь и переносится ко всем органам и тканям.
Секреция инсулина происходит импульсами; это объясняет значительные колебания содержания инсулина в крови в течение суток, что важно для эффективной регуляции обмена веществ. Она зависит в первую очередь от содержания глюкозы в крови: чем оно выше, тем больше инсулина образуется.
Действие инсулина
Механизм действия инсулина до конца неясен. Установлено, что в клетках периферических органов гормон связывается со своим рецептором – трансмембранным белком, вызывая изменение его конформации и активацию внутреннего, обращённого в цитоплазму домена, обладающего свойствами протеинкиназы. Результатом этих событий является аутофосфорилирование рецептора и фосфорилирование (по остаткам тирозина) с последующей активацией определённых ферментов и мембранных переносчиков глюкозы.
Действие инсулина реализуется через усиление поглощения клетками глюкозы (в наибольшей степени от него зависит транспорт глюкозы в т. н. инсулинозависимых тканях – мышечной и жировой), активацию ключевых ферментов гликолиза, образование гликогена (гликогенез) в печени и скелетных мышцах, торможение процесса синтеза глюкозы из неуглеводных предшественников – глюконеогенеза. Кроме того, в печени и жировой ткани инсулин препятствует липолизу – распаду жирных кислот и, напротив, способствует липогенезу – превращению глюкозы в триглицериды и накоплению жировых запасов. Инсулин повышает также интенсивность синтеза белка, усиливает транспорт через клеточную мембрану в клетку аминокислот, ионов калия, магния и фосфата и др.
Регуляция секреции инсулина и её нарушения
В норме основная роль в поддержании оптимальной концентрации глюкозы в крови принадлежит гормональной регуляции – координированному действию инсулина и его антагонистов – гормонов глюкагон, соматотропин и адреналин. Повреждение бета-клеток поджелудочной железы в результате аутоиммунных реакций или действия токсических веществ сопровождается уменьшением доли углеводов в обмене веществ, повышением уровня циркулирующей глюкозы (гипергликемия), развитием инсулинозависимого сахарного диабета 1-го типа. Избыточная секреция инсулина наблюдается при инсулиноме – опухоли островковой ткани поджелудочной железы, при развитии которой происходит резкое снижение содержания глюкозы в крови (гипогликемия). У некоторых млекопитающих повышение секреции инсулина предшествует наступлению сезонной спячки.
Для медицинских целей инсулин получают либо полусинтетическим способом (например, превращением свиного инсулина в инсулин человека заменой одного из С-концевых аминокислотных остатков), либо используя методы генетической инженерии.