Тирозин
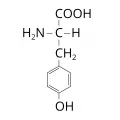
Тирози́н [(α-амино-β-(п-гидроксифенил)пропионовая кислота, 2-амино-3-(п-гидроксифенил)пропановая кислота, общепринятые сокращения: Tyr, Y, Тир], ароматическая α-аминокислота. Содержит асимметрический атом углерода, обладает оптической активностью, существует в виде двух энантиомеров – L-тирозина и D-тирозина. Молярная масса 181,18 г/моль. Плотность 1,456 г/см3. Температура плавления 290–295 °C (с разложением) для L-тирозина, 310–314 °C для D-тирозина, 340 °C (с разложением) для DL-тирозина. Впервые тирозин был выделен из казеина сыра в 1846 г. немецким учёным Ю. фон Либихом.
L-тирозин – протеиногенная аминокислота, кодируется триплетами UAU и UAC, присутствует в белках (частота встречаемости 2,81), участвует в биосинтезе ряда гормонов, нейромедиаторов и других биологически активных соединений, вовлечён в передачу внеклеточных сигналов, регуляцию клеточного цикла. L-тирозин является заменимой для человека аминокислотой.
Физико-химические свойства
Тирозин – бесцветное кристаллическое вещество, растворимо в воде [для L-тирозина 0,048 г/100 мл (25 °C), 0,235 г/100 мл (75 °C), для DL-тирозина 0,041 г/100 мл (20 °C)], малорастворимо в этаноле [для L-фенилаланина 0,01 г/100 мл (17 °C)], нерастворимо в диэтиловом эфире.
Как и другие аминокислоты, в кристаллах и полярных растворителях тирозин существует в виде цвиттер-иона. Его изоэлектрическая точка равна 5,66. Константы диссоциации кислоты (рКа) составляют 2,20 для карбоксильной группы (α-COOH), 9,11 для аминогруппы (α-NH3+), 10,7 для гидроксильной группы.
Тирозин взаимодействует с кислотами и щелочами, образует комплексы с металлами, вступает в реакции, характерные для карбоновых кислот и аминов, а именно: реакции этерификации, взаимодействие с аминами, декарбоксилирование, реакции с азотистой кислотой, окислительное дезаминирование, переаминирование, N-алкилирование, N-ацилирование, образование пептидной связи. Химические свойства тирозина обусловлены наличием реакционноспособного фенольного гидроксила: нагревание до 270 °С приводит к декарбоксилированию до тирамина, щелочное плавление даёт 4-гидроксибензойную кислоту, при нитровании и иодировании ароматического цикла образуются соответствующие 3- и 3,5-производные. В качественных реакциях тирозин даёт окрашенные продукты: с диазотированной сульфаниловой кислотой в щелочном растворе (реакция Паули) или с HgNO3 в азотной кислоте в присутствии азотистой кислоты (реакция Миллона) – красный, с фосфомолибденово-вольфрамовой кислотой (реакция Фолина – Чокалтеу) – синий, с кипящей концентрированной азотной кислотой (ксантопротеиновая реакция) – жёлтый.
Способность тирозина поглощать ультрафиолетовый свет приводит к характеристической адсорбции белков при длине волны 280 нм, что широко используется в исследовательских целях.
Способы получения
DL-тирозин выделяют из белковых гидролизатов. L-тирозин получают из фенола и серина или фенола, пировиноградной кислоты и аммиака под действием тирозинфеноллиазы (КФ 4.1.99.2).
Участие в обмене веществ
L-тирозин – заменимая аминокислота, в организме человека синтезируется из незаменимой аминокислоты L-фенилаланина под действием фенилаланингидроксилазы (КФ 1.14.16.1).
L-тирозин участвует в биосинтезе дофамина, адреналина, норадреналина, меланинов, катехоламинов, гормонов трииодтиронина и тироксина и других биологически активных соединений. У растений L-тирозин участвует в синтезе алкалоидов – морфина, кодеина и др. При распаде L-тирозина в организме образуются фумаровая и ацетоуксусная кислоты, которые через ацилированное производное кофермента А включаются в цикл трикарбоновых кислот.
L-тирозин входит в состав молекул белков (12,8% в фиброине шёлка, 14,75 в папаине).
За счёт ароматической фенольной группы L-тирозин может принимать участие в гидрофобных взаимодействиях, стабилизируя структуру белков. Кроме того, он способен к образованию водородной связи, является важной функциональной группой ряда ферментов. Фосфорилированием и дефосфорилированием L-тирозина можно регулировать активность ферментов [рецепторы тирозиновых киназ (передача внеклеточных сигналов), циклинзависимые киназы (регуляция клеточного цикла)].
Остаток L-тирозин-161 белка D1 фотосистемы II служит переносчиком электронов между марганцевым кластером и специальной парой P680 (пара хлорофиллов a).
Генетически обусловленные нарушения превращений L-тирозина в организме человека приводят к тяжёлым заболеваниям: алкаптонурии и тирозинозам, развитию альбинизма [дефект гена тирозин-3-монооксигеназы (КФ 1.14.16.2)].
D-тирозин встречается в составе пептидных антибиотиков (бацилломицины).
Применение
Тирозин применяют в пищевом производстве, органическом синтезе. В медицине используют в составе средств парентерального питания и средств для лечения почечной недостаточности.