Аспарагин
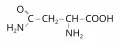
Аспараги́н (β-амид аспарагиновой кислоты, γ-амид-α-аминоянтарная кислота, 4-амид-2-аминобутандиовая кислота, общепринятые сокращения Asn, N, Асн), H2NCOCH2CH(NH2)COOH, алифатическая полярная незаряженная α-аминокислота. Содержит асимметрический атом углерода, обладает оптической активностью, существует в виде двух энантиомеров – L-аспарагина и D-аспарагина. В природе преобладает L-форма аспарагина. Молярная масса 132,11 г/моль. Плотность 1,543 г/см3. Температура плавления 236 °C. Аспарагин был первой выделенной аминокислотой. Л.-Н. Воклен и П. Ж. Робике получили его из спаржи в 1806 г.
L-аспарагин – заменимая протеиногенная α-аминокислота, кодируется триплетами, начинающимися с AA (AAU, AAC). Входит в состав белков (частота встречаемости 3,81), в свободном состоянии содержится в жидкостях и тканях растений и животных, участвует в азотистом обмене, в связывании токсичного аммиака, в образовании N-гликозидной связи между углеводным и белковым компонентами гликопротеинов.
L-аспарагин синтезируется в организме человека и является заменимой аминокислотой.
Физико-химические свойства
Аспарагин – бесцветное кристаллическое вещество, растворимое в воде [2,46 г/100 мл (25 °C), 8,6 г/100 мл (100 °C)], этаноле [0,0003 г/100 мл (100 °C)], нерастворимое в метаноле, диэтиловом эфире.
Как и другие аминокислоты, в кристаллах и полярных растворителях аспарагин существует в виде цвиттер-иона. Его изоэлектрическая точка равна 5,41. Константы диссоциации кислоты (рКа) составляют 2,02 для карбоксильной группы (α-COOH) и 8,80 для аминогруппы (α-NH3+).
Аспарагин взаимодействует с кислотами и щелочами, образует комплексы с металлами, вступает в реакции, характерные для карбоновых кислот и аминов, а именно: реакции этерификации, взаимодействие с аминами, декарбоксилирование, реакции с азотистой кислотой, окислительное дезаминирование, переаминирование, N-алкилирование, N-ацилирование, образование пептидной связи.
Способы получения
В промышленности L-аспарагин получают экстракцией из белкового гидролизата, используя в качестве сырья растительные белки или отходы мясной промышленности, которые подвергают кислотному гидролизу.
Можно синтезировать L-аспарагин при действии аммиака на моноэтиловый эфир L-аспарагиновой кислоты.
Участие в обмене веществ
Прекурсором аспарагина в клетке является оксалоацетат, который на первом этапе под действием аспартатаминотрансферазы (КФ 2.6.1.1) превращается в аспартат. Аспарагинсинтетаза (КФ 6.3.5.4) катализирует дальнейшее превращение аспартата в аспарагин. Путём образования аспарагина из аспарагиновой кислоты в организме происходит связывание токсичного аммиака.
Расщепление аспарагина проходит в две стадии, сначала L-аспарагиназа (КФ 3.5.1.1 ) гидролизует амидную группу с образованием аспартата, который превращается в оксалоацетат под действием трансаминазы.
L-аспарагин входит в состав белков (им богаты семена и проростки растений, например вики, фасоли, гороха, спаржи); в свободном состоянии содержится в жидкостях и тканях растений и животных.
Участвует в азотистом обмене (в том числе в реакциях переаминирования), в образовании N-гликозидной связи между углеводным и белковым компонентами гликопротеинов.
Наряду с L-глутамином L-аспарагин играет роль растворимого NH2-содержащего резервного соединения при биосинтезе белков у многих растений.
Присутствие свободного L-аспарагина в сыворотке крови необходимо для роста и размножения патологических клеток при острой лимфобластной лейкемии. В химиотерапевтических целях использовали генно-инженерную L-аспарагиназу, снижающую концентрацию этой аминокислоты в крови.
D-аспарагин был найден в составе пептидных антибиотиков (балломицины), нейропептидов моллюсков (фулицин).
Применение
Применяется в медицине в составе препаратов, восполняющих дефицит калия и магния в организме.