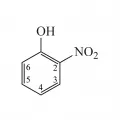
Нитрофенолы
Нитрофено́лы (гидроксинитробензолы), производные фенола общей формулы HOC6H5–n(NO2)n. Нитрофенолы – бесцветные или жёлтые кристаллы; растворяются в этаноле, диэтиловом эфире, бензоле и других органических растворителях, плохо растворяются в воде. Наибольшее применение имеют 2-, 3- и 4-мононитрофенолы (о-, м-, п-нитрофенолы; tпл 45–46, 97 и 114–115 °С), 2,4-, 2,5-, 2,6-динитрофенолы (tпл 115–116, 108, 63–64 °С), 2,4,6-тринитрофенол (tпл 22,5 °С).
Нитрофенолы обладают свойствами фенолов и ароматических нитросоединений. Со щелочами образуют соли (нитрофеноляты); вступают в реакции электрофильного замещения (алкилирования, нитрования, бромирования, сульфирования и др.), которые для 4-нитрофенола протекают исключительно по положению 2, для 3-нитрофенола – в основном по положениям 4 и 6; при восстановлении нитрофенолы превращаются в соответствующие аминофенолы. Ди- и тринитрофенолы образуют с СН-кислотами в присутствии щелочей окрашенные продукты присоединения – анионные σ-комплексы Майзенхаймера.
В промышленности 2- и 4-нитрофенолы производят щелочным гидролизом 2- и 4-хлорнитробензолов, 3-нитрофенолы – диазотированием 3-нитроанилина с последующим замещением диазогруппы на гидроксильную, динитрофенол – нитрованием фенолов или мононитрофенолов, а также щелочным гидролизом 2,4-динитрохлорбензола, 2,4,6-тринитрофенол – нитрованием 2,4-динитрофенола.
Применяют нитрофенолы в производстве красителей, пестицидов, антисептиков, 2-нитрофенола, аминофенолов, 2,4-диаминофенола, пикриновой кислоты (тринитрофенола). Мононитрофенолы используют в аналитической химии в качестве кислотно-оснóвных индикаторов.
Нитрофенолы токсичны; мононитрофенолы поражают нервную систему, печень, почки; динитрофенолы раздражают кожу, слизистые оболочки, вызывают дерматиты. Нитрофенолы, содержащие 2 и более группы NO2, взрывоопасны.