Медиаторы (в биологии)
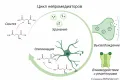
Медиа́торы (нейромедиаторы, нейротрансмиттеры, синаптические передатчики; от лат. mediator – посредник), биологически активные вещества, выделяемые нервными окончаниями;  Рис. 1. Варианты экзоцитоза молекул нейротрансмиттера из везикул в синаптическую щель.служат посредниками в процессе химической передачи нервного импульса с одного нейрона на другой или на возбудимые клетки периферических органов. Такие контакты осуществляются с помощью синапсов; передача сигналов происходит через синаптическую щель (рис. 1).
Рис. 1. Варианты экзоцитоза молекул нейротрансмиттера из везикул в синаптическую щель.служат посредниками в процессе химической передачи нервного импульса с одного нейрона на другой или на возбудимые клетки периферических органов. Такие контакты осуществляются с помощью синапсов; передача сигналов происходит через синаптическую щель (рис. 1).
Все известные ныне медиаторы (около 30) представлены разнообразной группой соединений: ацетилхолин, катехоламины (дофамин, норадреналин, адреналин), серотонин, гистамин, некоторые аминокислоты (в том числе гамма-аминомасляная и глутаминовая кислоты, глицин, таурин) и другие низкомолекулярные соединения. Кроме того, роль медиаторов могут играть отдельные нейропептиды (субстанция Р, метэнкефалин, лейэнкефалин, эндорфины, нейротензин, кортикотропин, ангиотензин II, окситоцин, вазопрессин, холецистокинин, тиреолиберин, бомбезин и др.). Многие медиаторы выступают также в качестве гормонов или модуляторов синаптической передачи.
Механизм действия
Низкомолекулярные медиаторы чаще всего образуются в телах пресинаптических нейронов (перикарионе) и накапливаются в везикулах – мембранных пузырьках диаметром около 50 нм (в каждом из них заключено 1·104–5·105 молекул медиаторов). По аксону везикулы перемещаются к нервным окончаниям (здесь их число может достигать нескольких тысяч). В некоторых случаях синтез медиатора и его упаковка в везикулы частично происходит непосредственно в нервных окончаниях.
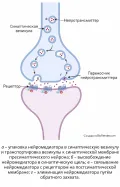 Рис. 2. Схема химического синапса.Выброс медиатора осуществляется под влиянием пресинаптического потенциала действия (ПД) с участием ионов Ca2+, которые входят в деполяризованную терминаль (окончание аксона) и связываются с регуляторным белком кальмодулином; при этом происходят структурные изменения ряда мембранных белков в активной зоне синапса, сопровождающиеся поступлением медиатора в синаптическую щель (рис. 2).
Рис. 2. Схема химического синапса.Выброс медиатора осуществляется под влиянием пресинаптического потенциала действия (ПД) с участием ионов Ca2+, которые входят в деполяризованную терминаль (окончание аксона) и связываются с регуляторным белком кальмодулином; при этом происходят структурные изменения ряда мембранных белков в активной зоне синапса, сопровождающиеся поступлением медиатора в синаптическую щель (рис. 2).
После взаимодействия медиатора с соответствующими рецепторами постсинаптической мембраны (каждому медиатору соответствует свой рецептор) изменяется (обычно повышается) её проницаемость для некоторых ионов в результате временного открывания (реже закрывания) определённых ионных каналов в постсинаптической клетке. При этом может иметь место как возбуждение, так и торможение постсинаптической клетки: если процессы, происходящие в синапсе, увеличивают вероятность возникновения ПД, то их называют возбуждающими. Напротив, если эта вероятность снижается, то говорят о торможении. Возбуждающие синаптические токи идут через Na+ или Ca2+, нередко и K+-каналы, тормозные – через K+ или Cl–-каналы (рис. 3). В то же время эффект действия каждого медиатора зависит от того, с рецепторами каких клеток он взаимодействует. Например, ацетилхолин, выделяющийся из окончаний двигательных нейронов, приводит к возбуждению волокон поперечно-полосатых мышц (они сокращаются), если же он выделяется из окончаний парасимпатических нервов, иннервирующих сердечную мышцу, то оказывает тормозящий эффект.
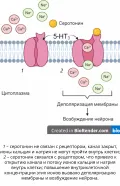 Рис. 3. Механизм действия серотонинового рецептора 5-HT₃.В одном и том же нейроне может находиться несколько медиаторов, причём они могут присутствовать как в разных, так и совместно в одних и тех же везикулах (например, в нейронах одного из видов улиток обнаружено 4 разных медиатора). Действие некоторых медиаторов (в том числе адреналина, некоторых нейропептидов) реализуется через взаимодействие с встроенным в цитоплазматическую мембрану белковым комплексом, в составе которого присутствуют рецептор медиатора и фермент аденилатциклаза. Взаимодействие медиатора с рецептором приводит к активации фермента, образованию циклического аденозинмонофосфата и последующему изменению внутриклеточных процессов.
Рис. 3. Механизм действия серотонинового рецептора 5-HT₃.В одном и том же нейроне может находиться несколько медиаторов, причём они могут присутствовать как в разных, так и совместно в одних и тех же везикулах (например, в нейронах одного из видов улиток обнаружено 4 разных медиатора). Действие некоторых медиаторов (в том числе адреналина, некоторых нейропептидов) реализуется через взаимодействие с встроенным в цитоплазматическую мембрану белковым комплексом, в составе которого присутствуют рецептор медиатора и фермент аденилатциклаза. Взаимодействие медиатора с рецептором приводит к активации фермента, образованию циклического аденозинмонофосфата и последующему изменению внутриклеточных процессов.
Медиаторы действуют в очень низких концентрациях. Например, холинорецепторы реагируют на появление ацетилхолина в синаптической щели уже при концентрации 10–8 моль/л; в норме в организмах она составляет 10–4–10–2 моль/л. Взаимодействие медиатора с рецепторами продолжается 1–3 мс, после чего он либо инактивируется (разрушается) соответствующим ферментом, либо захватывается обратно в пресинаптическое окончание и используется повторно. Длительное действие медиатора на соответствующие рецепторы приводит к снижению их чувствительности (т. н. десентизация рецепторов).
Медиаторы участвуют в управлении всеми системами организма. Любое нарушение в их образовании и функции приводит к серьёзным расстройствам. Например, выделенный из кураре алкалоид α-тубокурарин блокирует ацетилхолиновые рецепторы мышечных волокон, а токсины из ядов различных змей (тайпоксин, β-бунгаротоксин) и столбнячный токсин блокируют выброс ацетилхолина из пресинаптических нервных окончаний. Всё это сопровождается прекращением передачи возбуждения с нерва на мышцу, параличом и быстрой гибелью организма. Отклонениями в синтезе серотонина могут объясняться нарушение сна, появление состояния тревоги и депрессии, галлюцинации. При отмирании нейронов чёрной субстанции головного мозга, содержащих дофамин, человек теряет способность двигаться, развивается паркинсонизм.
Методы исследования
Анатомическая локализация нейромедиаторов обычно определяется с использованием иммуноцитохимических методов, которые выявляют местоположение либо самих медиаторов, либо ферментов, участвующих в их синтезе. Для определения нейронов, восприимчивых к нейромедиатору (т. е. для поиска клеток-мишеней) используют радиоактивные метки, пришиваемые на медиатор. Тип синапса также может быть установлен с помощью зондов, распознающих рецепторы на постсинаптических клетках.
Одним из способов изучения роли компонентов нейромедиаторных систем на нормальное и патологическое поведение является манипулирование экспрессией целевых генов у животных моделей и дальнейшее изучение поведенческих и молекулярных изменений. Так, например, исследователи из Института мозга, познания и поведения Дондерса (Нидерланды) проверили, способствует ли ангедонии принятия решений нокаут гена транспортёра серотонина, и выяснили, что эффект абляции транспортёра на ангедонию принятия решений является умеренным и взаимодействует с обучением, объясняя противоречивые данные о связи между геном серотонинового транспортёра и депрессией (Guo. 2021).
Дефицит нейромедиаторов приводит к редким неврологическим расстройствам, причиной которых являются дефекты генов тех ферментов, которые участвую в синтезе, деградации или транспорте нейромедиаторов, или дефектами в биосинтезе кофактора (Inherited disorders of neurotransmitters. 2019). Для изучения таких патологий и разработки препаратов также могут использоваться животные модели с генетической предрасположенностью к тому или иному дефициту нейромедиаторов. Подобный подход позволяет нацелиться на поиск новых терапевтических мишеней, выяснить пути развития неврологических патологий, изучить нейродегенеративные заболевания, вызванные дисбалансом нейромедиаторных систем, искать новые способы их лечения.
Нейротехнологии, которые обеспечивают высокую пропускную способность, а также быстрое и точное количественное определение целевых аналитов в головном мозге без негативного воздействия на имплантируемую область, крайне необходимы для мониторинга сложной взаимосвязи нейромедиаторов и выявления изменений их функций у пациентов (Electrochemical Detection of Neurotransmitters. 2020).
Один из самых мощных методов нейровизуализации, который дает возможность количественно оценить уровень нейромедиаторов в норме и при патологии, – позитронно-эмиссионная томография (ПЭТ) – позволяет представить полную картину молекулярной динамики живого мозга. Комбинация ПЭТ и функциональной магнитно-резонансной томографии (фМРТ) делает возможным установление связи между дисбалансом в нейромедиаторных системах мозга и изменениями в его функциональной активности (Methods for quantifying ... 2020).
Медиаторы в медицине. Отдельные аспекты
В патогенезе болезни Альцгеймера играют решающую роль такие нейромедиаторные системы, как ацетилхолинергическая, ГАМКергическая, глутаматергическая, гистидинергическая, серотонинергическая. После исследований по профилактике болезни Альцгеймера были одобрены ингибиторы ацетилхолинэстеразы, а также антагонисты NMDA-рецептора (Kandimalla. 2017).
Эпилептические припадки могут развиваться из-за относительного дисбаланса возбуждающих и тормозящих нейромедиаторов. Изменения экспрессии рецепторов и ионных каналов, активируемых нейромедиаторами, могут привести к развитию эпилепсии. Решающую роль в патофизиологии этого процесса играют глутамат и гамма-аминомасляная кислота (ГАМК) – в результате аномальных изменений в уровне этих соединений может произойти необратимое повреждение нейронов. Кроме того, некоторые данные указывают на участие в патогенезе эпилепсии таких нейромедиаторов, как дофамин, норадреналин, серотонин и гистамин (Revisiting the role of neurotransmitters in epilepsy. 2020), следовательно, мы получаем широкий спектр потенциальных мишеней для новых лекарственных средств, разработка которых активно ведётся в настоящее время.
Нейромедиаторы влияют на врождённые и адаптивные иммунные реакции. Изменённая коммуникация между нервной и иммунной системами становится общей чертой нейродегенеративных и иммунопатологических заболеваний. Таким образом, нейроиммунная коммуникация является перспективной междисциплинарной областью исследований, имеющей отношение к изучению методов лечения хронических иммунопатологий. Использование передовых технологий генетического молекулярного картирования и визуализации, высокопроизводительное секвенирование ДНК одиночных клеток и вычислительная системная биология, комплексный анализ нейроиммунной модуляции и др. способствует поиску новых функциональных основ и регуляторных схем нейроиммунных сетей. Основываясь на этих достижениях, тщательно оптимизированный подход нейроиммунотерапии способен обеспечить целостное терапевтическое воздействие при хронических воспалительных заболеваниях без явного вреда для физиологических систем организма (Critical neurotransmitters in the neuroimmune network. 2020).
Новые данные свидетельствуют о том, что раковые клетки используют преимущества сигнального пути, инициируемого нейромедиаторами, для активации неконтролируемой пролиферации и распространения. Нейромедиаторы могут воздействовать на иммунные и эндотелиальные клетки в микроокружении опухоли, способствуя ее прогрессированию (Neurotransmitters. 2019). Понимание механизмов, лежащих в основе участия нейромедиаторов в онкогенезе, ангиогенезе и воспалении, позволит разработать противоопухолевую терапию следующего поколения.