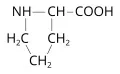
Пролин
Проли́н (пирролидин-α-карбоновая кислота, пирролидин-2-карбоновая кислота, общепринятые сокращения: Pro, P, Про), (название от пирролидина, производным которого является пролин), неполярная алифатическая аминокислота; единственная из кодируемых аминокислот, α-аминогруппа которой является фрагментом гетероцикла (иминокислота). Содержит асимметрический атом углерода, обладает оптической активностью, существует в виде двух энантиомеров – L-пролин и D-пролин. В природе преобладает L-форма. Молярная масса 115,13 г/моль. Плотность 1,35–1,38 г/см³. Температура плавления 205 °C (DL-пролин), 215–220 °C (D-пролин), 220–222 °C (L-пролин), все с разложением. Пролин впервые был выделен из казеина (1901, Э. Фишер). В 1900 г. Р. Вильштеттер получил эту аминокислоту в реакции натриевой соли диэтилового эфира малоновой кислоты с 1,3-дибромпропаном.
L-пролин – протеиногенная аминокислота, кодируется триплетами, начинающимися с CC (CCU, CCC, CCA, CCG). Входит в состав практически всех природных белков (частота встречаемости 5,24), биологически активных пептидов.
L-пролин является заменимой для человека аминокислотой (может синтезироваться в организме).
Физико-химические свойства
Пролин – бесцветное кристаллическое вещество, растворимое в воде [16,23 г/100 мл (25 °C)], этаноле [1,55 г/100 мл (19 °C)], нерастворимое в диэтиловом эфире.
Как и другие аминокислоты, в кристаллах и полярных растворителях пролин существует в виде цвиттер-иона. Его изоэлектрическая точка равна 6,30. Константы диссоциации кислоты (рКа) составляют 1,99 для карбоксильной группы (α-COOH), 10,60 для аминогруппы (α-NH3+).
Пролин взаимодействует с кислотами и щелочами, образует комплексы с металлами, вступает в реакции, характерные для карбоновых кислот и аминов, а именно: реакции этерификации, взаимодействие с аминами, декарбоксилирование, реакции с азотистой кислотой, окислительное деаминирование, переаминирование, N-алкилирование, N-ацилирование, образование пептидной связи. В отличие от других аминокислот пролин даёт жёлтую окраску при взаимодействии с нингидрином. В качественной реакции с изатином пролин даёт синее окрашивание.
Обладая жёсткой структурой, L-пролин способствует резким изгибам полипептидной цепи (β-поворот I типа), нарушая структуру α-спирали или β-листа. Белки с высоким содержанием L-пролина (например, коллаген) формируют левозакрученную полипропиленовую спираль II типа.
Способы получения
DL-пролин можно синтезировать из диэтилового эфира малоновой кислоты и акрилонитрила или аминированием α, δ-дихлорвалериановой кислоты. L-пролин получают микробной ферментацией.
Участие в обмене веществ
Предшественником в биосинтезе L-пролина служит глутаминовая кислота.
Конечным продуктом катаболизма L-пролина является α-кетоглуторат.
В виде L-изомера входит в состав практически всех природных белков (6,9 % в сальмине, 10,6 % в казеине, 16,3 % в желатине), адренокортикотропного гормона, пептидного антибиотика грамицидина С и ряда других биологически активных пептидов. В некоторых белках L-пролин подвергается посттрансляционной модификации с образованием 3- и особенно 4-гидроксипролина. L-пролин, 3- и 4-гидроксипролин составляют почти треть всех аминокислотных остатков коллагена, фибриллярного белка, составляющего основу соединительной ткани организма. Другие производные L-пролина – 4-метилпролин и 4-гидроксиметилпролин встречаются в антибиотиках.
L-пролин защищает растения от абиотического стресса, выступая в качестве осмолитика, антиоксиданта, хелатирующего агента и регулятора специфических генов, ответственных за выход из стресса.
D-пролин – составная часть алкалоидов спорыньи.
Повышение уровня D-пролина в крови человека ассоциировано с заболеваниями почек, сахарным диабетом и старением.
Применение
L-пролин применяется в медицине в составе средств парентерального питания.
Выступает в роли органического катализатора. Добавление 3–30 % L-пролина в реакционную смесь позволяет преимущественный синтез определенного энантиомера или диастереомера (энантиоселективный синтез).