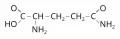Глутамин
Глутами́н (δ-амид-α-аминоглутаровая кислота, 5-амид-2-аминопентадионовая кислота, γ-амид глутаминовой кислоты, общепринятые сокращения Gln, Q, Глн), полярная, гидрофильная незаряженная α-аминокислота, H2NC(O)CH2CH2CH(NH2)COOH. Содержит асимметрический атом углерода, обладает оптической активностью, существует в виде двух энантиомеров – L-глутамина и D-глутамина. В природе преобладает L-форма глутамина. Молярная масса 146,35 г/моль. tпл 184°C (с разложением). Впервые был выделен из сахарной свёклы (1877, Е. Шульце).
L-глутамин – гликогенная аминокислота. Протеиногенная α-аминокислота, кодируется триплетами, начинающимися с CA (CAA, CAG), присутствует во всех белках (частота встречаемости 3,94%), занимает центральное место в азотистом обмене, является донором азота при синтезе многих соединений, связывает токсичный аммиак, служит источником энергии для быстро делящихся клеток.
L-глутамин является заменимой для человека аминокислотой (синтезируется в организме в достаточном количестве).
Физико-химические свойства
Глутамин – бесцветное кристаллическое вещество, растворимое воде [3,61 г/100 мл (18 °C)], нерастворимое в этаноле, диэтиловом эфире, бензоле, метаноле.
Как и другие аминокислоты, в кристаллах и полярных растворителях глутамин существует в виде цвиттер-иона. Его изоэлектрическая точка равна 5,65. Константы диссоциации кислоты (рКа) составляют 2,17 для карбоксильной группы (α-COOH) и 9,13 для аминогруппы (α-NH3+).
Глутамин может взаимодействовать со щелочами и кислотами, образует комплексы с металлами, участвует в реакциях, характерных для карбоновых кислот и аминов: реакции этерификации, взаимодействии с аминами, декарбоксилировании, реакции с азотистой кислотой, окислительном дезаминировании, переаминировании, N-алкилировании, N-ацилировании, образовании пептидной связи.
При нагревании глутамин циклизуется с образованием амида пироглутаминовой кислоты, который при нагревании с резорцином в присутствии концентрированной серной кислоты образует краситель, приобретающий красно-фиолетовый цвет в щелочной среде.
Способы получения
L-глутамин получают микробиологической ферментацией.
Участие в обмене веществ
Биосинтез L-глутамина происходит путём амидирования карбоксильной группы глутаминовой кислоты c использованием АТФ при участии фермента глутаминсинтетазы (КФ 6.3.1.2). Этот процесс сопровождается связыванием токсичного аммиака в тканях животных и растений. Продуктом катаболизма глутамина является α-кетоглутарат.
L-глутамин занимает центральное место в азотистом обмене: осуществляет транспортировку азота между органами, служит источником азота при биосинтезе пуринов, пиримидинов, аминосахаров, коферментов (рибофлавина, никотинамидадениндинуклеотида), аминокислот, участвует в реакциях переаминирования.
L-глутамин служит источником энергии для быстро делящихся клеток (например, иммунной системы, желудочно-кишечного тракта). Дефицит L-глутамина сопровождается снижением образования иммуноглобулина А и рядом тяжёлых функциональных нарушений работы кишечника.
L-изомер глутамина присутствует во всех организмах в свободном виде (например, в свёкле до 5,6% на сухую массу) и в составе белков (особенно протаминов и гистонов).
Применение
L-глутамин в составе дипептида с L-аланином применяют в медицине как средство парентерального питания.