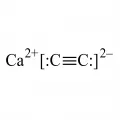Карбид кальция
Карби́д ка́льция, химическое соединение кальция с углеродом, CaC2.
Физико-химические свойства
Бесцветное кристаллическое вещество. Образец карбида кальция. Имеет четыре полиморфных модификации: при комнатной температуре устойчива модификация (CaC2 I) с тетрагональной решёткой (пространственная группа ), при медленном охлаждении которой ниже 0 °C происходит трансформация в низкотемпературную форму (CaC2 II) с моноклинной решеткой (пространственная группа ); метастабильная моноклинная модификация (CaC2 III, пространственная группа ) получается при нагреве CaC2 II выше 200 °C; кубическая модификация (CaC2 IV, пространственная группа ) устойчива выше 450–480 °C, при охлаждении переходит в CaC2 I (Konar. [2015]). При наличии в составе шихты для получения карбида кальция небольшого количества цианамида кальция возможно получение высокотемпературной триклинной модификации (Vannerberg. 1962).
Образец карбида кальция. Имеет четыре полиморфных модификации: при комнатной температуре устойчива модификация (CaC2 I) с тетрагональной решёткой (пространственная группа ), при медленном охлаждении которой ниже 0 °C происходит трансформация в низкотемпературную форму (CaC2 II) с моноклинной решеткой (пространственная группа ); метастабильная моноклинная модификация (CaC2 III, пространственная группа ) получается при нагреве CaC2 II выше 200 °C; кубическая модификация (CaC2 IV, пространственная группа ) устойчива выше 450–480 °C, при охлаждении переходит в CaC2 I (Konar. [2015]). При наличии в составе шихты для получения карбида кальция небольшого количества цианамида кальция возможно получение высокотемпературной триклинной модификации (Vannerberg. 1962).
Обладает высокой термической устойчивостью (tпл 2160 °C; tкип 2300 °C); плотность 2220 кг/м3. Удельная теплоёмкость при постоянном давлении 0,92 Дж/г·K (20–325 °C); стандартная энтальпия образования −62,8 кДж/моль; стандартная энергия Гиббса образования −67,8 кДж/моль; стандартная энтропия образования 70,3 Дж/моль·K; стандартная мольная теплоёмкость 62,34 Дж/моль·K; энтальпия плавления 32,2 кДж/моль. Имеет резкий чесночный запах.
Проявляет химические свойства карбидов щёлочноземельных металлов. Сильный восстановитель. Интенсивно реагирует с водой с образованием гидроксида кальция Ca(OH)2 и ацетилена. Реагирует с разбавленными минеральными кислотами и щелочами. При нагревании взаимодействует с водородом H2 (при 2000 °C), образуя гидрид кальция CaH2 и ацетилен, и с кислородом O2 (при 700 °C), образуя карбонат кальция CaCO3. Важное промышленное значение имеет реакция с азотом N2, протекающая при 1000 °C с образованием цианамида кальция CaCN2, используемого в качестве удобрения и реагента для получения цианидов.

Является очень ядовитым неорганическим соединением кальция (по степени воздействия на организм относится к 1 классу опасности по ГОСТ 12.1.007-76).
Получение
В промышленности карбид кальция получают взаимодействием извести с коксом или антрацитом в электродуговых печах при 1800–1900 °C. При этом получают технический продукт тёмно-серого или коричневого цвета, содержание карбида кальция в котором до 80 %. Для получения чистого вещества используют взаимодействие металлического кальция или гидрида кальция с углём при нагревании.
 Схема устройства электрической печи для производства карбида кальция.
Схема устройства электрической печи для производства карбида кальция.
Применение
Основная область применения – промышленный синтез. Наибольший объём потребления карбида кальция приходится на получение ацетилена путём взаимодействия с водой с выделением большого количества тепла. Эта реакция используется при сварке деталей из металлов (ацетиленовая сварка) и карбидных лампах. Ацетилен, получаемый из карбида кальция, идёт на производство синтетического каучука, уксусной кислоты, ацетона, этилена, винилхлорида, стирола. Используется для десульфуризации железа при производстве стали. Может быть применён для определения содержания влаги в почве.