Восстановители
Восстанови́тели, вещества, отдающие электроны в окислительно-восстановительных реакциях. Относительная восстановительная способность двух и более веществ определяется путём сравнения изменений энергии Гиббса () при реакциях этих веществ с одним и тем же окислителем, а в случае реакций с участием простых веществ – энергией Гиббса образования продуктов окисления простого вещества (оксидов, галогенидов и т. п.). Чем больше или абсолютная величина , тем более активным восстановителем является данное вещество. Так, при обычных условиях в реакциях кальций – более активный восстановитель фторидов металлов ( CaF2, отнесённая к одному атому фтора, составляет –584,2 кДж/моль), чем магний (–535,5 кДж/моль) и алюминий (–477,1 кДж/моль), но менее активный, чем литий (для LiF –588,0 кДж/моль). В случае электрохимических реакций для сравнения восстановительной способности веществ используют стандартный электродный потенциал Е0. Чем больше абсолютная величина Е0 полуреакции восстановления с участием данного вещества, тем более сильными восстановительными свойствами это вещество обладает.
К сильным восстановителям принадлежат щелочные и щёлочноземельные металлы, Al, Si, С, Н2 и ряд других простых веществ, гидриды металлов и соединения, содержащие неметаллы с отрицательными степенями окисления . Очень сильной восстановительной способностью обладают растворы, содержащие свободные или сольватированные электроны, например аммиачные растворы щелочных и щёлочноземельных металлов, а также атомарный водород.
Существуют вещества, которые в одной и той же окислительно-восстановительной реакции являются одновременно и восстановителем, и окислителями. В молекуле таких веществ содержатся атомы, отдающие и присоединяющие электроны.
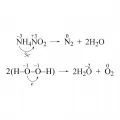 Реакции, в которых вещества являются одновременно восстановителями и окислителями.В различных процессах одни и те же вещества могут быть восстановителями или окислителями, например вода в реакциях:
Реакции, в которых вещества являются одновременно восстановителями и окислителями.В различных процессах одни и те же вещества могут быть восстановителями или окислителями, например вода в реакциях:
Восстановители применяют: для восстановления железа из руд (С, Н2, водяной и пририродный газы, СО, пропан, бутан); при получении цветных и редких металлов в процессах металлотермии (С, Si, Al, Na, Ca, Mg, La); при выделении (цементации) цветных металлов из водных растворов их солей (Fe, Zn); при получении металлов их низших оксидов и галогенидов и при химическом осаждении металлов, нитридов и карбидов из газовой фазы (Н2, NH3, CH4 и др.); при проведении различных химических процессов в растворах (SnCl2, FeSO4, H2SO3, N2H4, NH2OH, HCOOH, H2S и др.); в органическом синтезе (Н2, Na, Zn, Li[AlH4], Na[BH4], B2H6 и др.); как проявляющие вещества в фотографии (гидрохинон, амидол, метол, фенидон и др.). В химических источниках тока восстановители (Li, Na, Zn, некоторые другие металлы, а также сплавы) входят в состав анодов.
