Флуоресцентные белки
Флуоресцéнтные белки́ (от лат. Fluorum – фтор и лат. форманта -escent, означающего начало, становление, стремление быть), характеризуются способностью в ответ на облучение светом определённой длины волны излучать свет в более длинноволновой области спектра. Для испускания света используется хромофорный элемент. При поглощении молекулой хромофора кванта света её электрон переходит на более высокий энергетический уровень, а затем возвращается к исходному состоянию, испуская фотон. Поскольку часть энергии теряется, излучённый свет имеет меньшую энергию и, соответственно, большую длину волны, чем поглощённый.
В семействе т. н. классических GFP-подобных флуоресцентных белков (green fluorescent protein, зелёный флуоресцентный белок) – хромофор образуется автокаталитически, без участия внешних кофакторов и ферментов, путём посттрансляционных модификаций аминокислот. Помимо этого, существуют биливердин-, билирубин- и флавин-связывающие флуоресцентные белки.
Флуоресцентные белки обнаружены только у животных, причем исключительно морских: некоторых бактерий, кишечнополостных (гидроидных медуз и коралловых полипов), а также ракообразных и даже низших хордовых (ланцетников). Среди представителей архей, растений и грибов флуоресцентные белки пока не найдены.
Изучение флуоресцентных белков началось с работ Симомуры Осаму, Ф. Джонсона и Сайги Ё, которые отметили различие между цветом свечения живой медузы Aequorea victoria – зелёным – и цветом свечения выделенного из неё люминесцентного комплекса с белком экворином – синим.
Типы флуоресцентных белков
GFP-подобные белки
Семейство белков-гомологов GFP примечательно тем, что его представителям для обретения оптических свойств не нужна внешняя хромофорная группа или ионы тяжёлых металлов. Хромофор, представляющий собой 3 модифицированных аминокислотных остатка, созревает автокаталитически внутри белковой глобулы в присутствии молекулярного кислорода. Этот процесс занимает от нескольких минут до нескольких часов после синтеза белка. При созревании хромофора зелёного флуоресцентного белка в его пептидной цепи образуется р-гидроксибензилиден-имидазолинон из аминокислотных остатков серина-65, тирозина-66 и глицина-67.
Флуоресцентные белки других цветов часто имеют другие аминокислотные остатки, входящие в состав хромофора. Например, голубые флуоресцентные белки вместо тирозина-66 содержат триптофан, а синие – гистидин; жёлтые, оранжевые и красные белки вместо серина-65 могут иметь гистидин, циклизованный лизин или треонин (Family of the green fluorescent protein ... 2002; Modern fluorescent proteins. 2011). Синтетические соединения, аналогичные по структуре хромофорам флуоресцентных белков, в растворе практически не проявляют флуоресценции из-за быстрой изомеризации молекулы после поглощения кванта света. В составе белка хромофорная группа фиксирована белковым окружением, и поэтому квантовый выход флуоресценции может быть более 90 %.
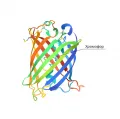
Пептидная цепь GFP-подобных белков сворачивается в т. н. бета-бочонок, внутри которого помещается хромофор. Стенки «бочки» образованы 11 бета-тяжами, а «крышка», «дно» и связки с хромофором – aльфа-спиральными участками белковой молекулы. GFP состоит из 238 аминокислотных остатков (молекулярная масса 28 кДа), его родственные белки обладают примерно такими же размерами.
Методами случайного и направленного мутагенеза получены белки, цвета флуоресценции которых – от синего до дальнего красного – покрывают весь спектр видимого излучения.
Другими модификациями флуоресцентных белков являются фотоактивируемые белки (обретают способность к флуоресценции после облучения светом с определённой длиной волны) (Henderson. 2009) и фотопереключаемые белки (изменяют цвет флуоресценции после облучения) (An optical marker based ... 2002); флуоресцентные таймеры («Fluorescent timer». 2000) (меняют цвет флуоресценции во времени); фототоксичные флуоресцентные белки (A genetically encoded photosensitizer. 2006) (при облучении светом, возбуждающим их флуоресценцию, генерируют активные формы кислорода).
Флавин-связывающие флуоресцентные белки
К данной группе относят белки, специфически связывающие производные флавина, – флавинмононуклеотид (ФМН) или флавинадениндинуклеотид (ФАД), которые выполняют роль флуорофорной группы. Флавин-связывающие флуоресцентные белки (ФСФБ) получены путём искусственной модификации природных нефлуоресцентных белков бактерий или растений. Например, на основе сенсорного белка SB2 из бактерий Pseudomonas putida получен флуоресцентный белок PpFbFP; из N-концевого LOV- (light, oxygen or voltage-sensing) домена рецептора синего света YtvA сенной палочки (Bacillus subtilis) – белок BsFbFP. Два других LOV-домена преобразованы в флуоресцентные белки путём замены консервативного цистеина на аланин, в результате чего из P. putida был получен белок Pp1FbFP, а и из фотогетеротрофных бактерий Dinoroseobacter shibae – белок DsFbFP. Из LOV-домена рецептора синего света фототропина II резуховидки Таля (Arabidopsis thaliana) получены флуоресцентный белок iLOV (improved LOV) и фотосенсибилизатор miniSOG (mini singlet oxygen generator).
Поскольку ФМН и ФАД присутствуют в любой клетке, экспрессия гена приводит к появлению специфической флуоресценции. В отличие от GFP-подобных белков молекулярный кислород не участвует в формировании хромофора, поэтому ФСФБ могут быть использованы в том числе в анаэробных организмах и условиях. Другим преимуществом ФСФБ является их небольшой размер – около 115 аминокислотных остатков (в два раза меньше GFP) (LOV-based reporters for fluorescence imaging. 2015).
Биливердин-связывающие ближние инфракрасные флуоресцентные белки
Ряд флуоресцентных белков получен генно-инженерными методами на основе бактериальных фитохромов. Примерами используемых бактериофитохромов являются DrBphP из грамположительного кокка Deinococcus radiodurans, RpBphP6 и RpBphP2 из бактерии Rhodopseudomonas palustris, AtBphP2 из фитопатогенной бактерий Agrobacterium tumefaciens. На основе данных белков был получен целый ряд инфракрасных флуоресцентных белков от IFP1.4 и iRFP (infrared fluorescent protein) до Wi-Phy, IFP1.4rev и т. д., с максимумом флуоресценции при длине волны вплоть до 720 нм (Shcherbakova. 2015). В качестве ковалентно связанного кофактора-хромофора они используют присутствующий в клетках биливердин, за счёт которого достигается сдвиг поглощения и флуоресценции в дальнюю красную и ближнюю инфракрасную области спектра (хотя и с относительно низким квантовым выходом 10–15 %), недостижимые для других типов флуоресцентных белков. Это дает существенные преимущества при визуализации клеток в тканях животных, которые обладают повышенной проницаемостью для света с длиной волны в области 650–900 нм. Получены как обычные флуоресцентные, так и фотопереключаемые флуоресцентные белки на основе бактериофитохромов.
Билирубин-связывающие флуоресцентные белки
В 2013 г. был описан представитель нового типа природных флуоресцентных белков – билирубин-связывающий белок, названный UnaG и относящийся к обширному семейству белков, связывающих жирные кислоты. UnaG определяет окраску мышц японского речного угря (Anguilla japonica). Этот белок флуоресцирует с высоким квантовым выходом в зелёной области спектра благодаря высокоаффинному нековалентному связыванию билирубина, который присутствует в достаточном количестве в клетках эукариот. UnaG сходен по размеру с ФСФБ и не требует молекулярного кислорода для своего созревания (A bilirubin-inducible fluorescent protein from eel muscle. 2013). К 2022 г. известен только один представитель этого типа флуоресцентных белков, но, поскольку многие виды рыб имеют зелёную флуоресцентную окраску, вероятно, гомологи UnaG будут найдены в будущем.
Биологическое значение флуоресцентных белков
В природе флуоресцентные белки найдены исключительно у морских представителей: медуз, коралловых полипов, ракообразных и ланцетников. В настоящее время точная функция флуоресцентных белков в данных организмах неизвестна, но есть несколько гипотез (Лукьянов. 2020):
функция вторичного излучателя, когда флуоресцентный белок состоит в паре с люминесцентным, – флуоресцентный белок увеличивает яркость сигнала и смещает свет в менее рассеиваемую область спектра (например, GFP в паре с экворином у медуз A. victoria);
в кораллах – защита эндосимбиотических водорослей при избытке света и переизлучение света с возможностью его поглощения водорослями при его недостатке;
у организмов, имеющих зрение, – участие в распознавании представителей своего вида (например, у рачков Copepoda);
мимикрирующая, предупреждающая или заманивающая жертву (например, медуза Olindias formosus так завлекает рыб) функция флуоресцентной окраски.
Применение флуоресцентных белков
Флуоресцентные белки в основном используют в качестве генетически кодируемой метки для визуализации различных структур или процессов внутри клетки или организма in vitro и in vivo.
Мечение целых клеток
Частный случай клеточной визуализации получил даже специальное название – Brainbow: в нём по принципу аддитивной цветовой модели RGB (red, R – красный, green, G – зелёный и blue, B – синий) каждый нейрон получает случайный набор красных, зелёных и синих флуоресцентных белков, приобретая уникальную окраску (Transgenic strategies for combinatorial expression ... 2007). Другой пример – отслеживание судьбы клеток в ходе онтогенеза с помощью фотоактивируемых или фотопереключаемых белков (Fluorescent proteins and their applications ... 2010).
Изучение регуляторных элементов экспрессии генов
Разработаны разнообразные варианты: в частности, путём размещения последовательности гена флуоресцентного белка после определённых клеточных промоторов или использование флуоресцентных таймеров для оценки динамики экспрессии генов в различных тканях (Fluorescent proteins and their applications ... 2010).
Изучение локализации или изменений в динамике различных клеточных структур
Для выполнения подобных задач встраивают ген флуоресцентного белка в одной рамке считывания с другим белком, например актином, гистоном, сигналом локализации в митохондрии или ядре и т. п. (Fluorescent proteins and their applications ... 2010).
Флуоресцентная микроскопия сверхвысокого разрешения (наноскопия)
Является одним из перспективных направлений технологий с использованием флуоресцентных белков, поскольку позволяет получать детальные изображения клеточных структур в нанометровой шкале с использованием оптического (светового) микроскопа (Sejoo Jeong. 2022), т. е. обладая пространственным разрешением, в несколько раз превышающим теоретический предел оптической дифракции.
Создание молекулярных сенсоров
На основе флуоресцентных белков получены различные инструменты для оценки биохимических процессов в клетке [например, для изучения изменения pH; концентрации ионов кальция, пероксида водорода, циклического аденозинмонофосфата (цАМФ); активности каспаз, киназ и др.] (Fluorescent proteins and their applications ... 2010). В сочетании с технологиями машинного обучения получают сенсоры нового поколения, например для оценки состояния эпигенетических маркеров хроматина (Studying chromatin epigenetics ... 2022).
Фототоксичные флуоресцентные белки
Данный инструмент используют одновременно для визуализации и инактивации клеточной мишени или целой клетки, в которую направили «белок-убийцу» (KillerRed, KillerOrange, miniSOG и др.) (Light-induced oxidant production by fluorescent proteins. 2018).
Биомедицинские исследования
Один из примеров: апобелок UnaG применяют для быстрой количественной оценки билирубина в биологических жидкостях человека и животных в исследовательских целях (Tran Tien Tai. 2022).
Ненаучные способы применения
В развлекательных целях с помощью флуоресцентных белков создают картины, «нарисованные» на чашке Петри бактериями, экспрессирующими гены разноцветных флуоресцентных белков. В зоомагазинах повсеместно можно купить трансгенных аквариумных рыбок, ярко окрашенных за счет GFP-подобных белков различных цветов [Светящиеся (флуоресцентные) аквариумные рыбки – немного истории].