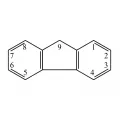
Флуорен
Флуоре́н (о,о'-дифениленметан), полициклический ароматический углеводород, C13H10. Молярная масса 166,2 г/моль.
Физико-химические свойства
Представляет собой бесцветные кристаллы, флуоресцирующие в УФ-свете; плотность 1,203 г/см3 (при 0 °C); tпл 116–117 °C, tкип 295 °C; теплота плавления 121 кДж/кг; теплота сгорания –39940 кДж/кг; абсолютная величина дипольного момента 1,9347 · 10–30 Кл · м; рКа 22,9. Хорошо растворяется в диэтиловом эфире, плохо – в этаноле, не растворяется в воде.
Флуорен окисляется кислородом воздуха до 9-гидропероксифлуорена, дихроматом калия K2Cr2O7 в уксусной кислоте CH3COOH – до флуоренона (tпл 84 °C, tкип 342 °C), иодоводородом HI и красным фосфором восстанавливается до пергидрофлуорена. 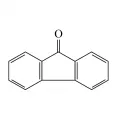 Cтруктурная формула флуоренона.Легко образует карбанион по атому С-9: при конденсации с ароматическими альдегидами даёт 9-арилиденфлуорены, при нагревании с натрием или амидом натрия NaNH2 – 9-натрийпроизводное, с акрилонитрилом и бензилхлоридом в присутствии катализатора – соответствующие 9,9-дизамещённые. Электрофильное замещение происходит предпочтительно по положению 2: галогенирование сульфурилхлоридом SO2Cl2 или хлором Cl2 в хлорметане CH3Cl на холоде приводит к 2-хлорфлуорену, дальнейшее хлорирование – к 2,7-дихлор- и 2,4,7-трихлорфлуоренам, нитрование – к 2-нитропроизводному, сульфирование – к 2-сульфо- и 2,7-дисульфопроизводным. С динитробензолом, тринитротолуолом, пикриновой кислотой флуорен образует молекулярное соединение (tпл пикрата 80–82 °C).
Cтруктурная формула флуоренона.Легко образует карбанион по атому С-9: при конденсации с ароматическими альдегидами даёт 9-арилиденфлуорены, при нагревании с натрием или амидом натрия NaNH2 – 9-натрийпроизводное, с акрилонитрилом и бензилхлоридом в присутствии катализатора – соответствующие 9,9-дизамещённые. Электрофильное замещение происходит предпочтительно по положению 2: галогенирование сульфурилхлоридом SO2Cl2 или хлором Cl2 в хлорметане CH3Cl на холоде приводит к 2-хлорфлуорену, дальнейшее хлорирование – к 2,7-дихлор- и 2,4,7-трихлорфлуоренам, нитрование – к 2-нитропроизводному, сульфирование – к 2-сульфо- и 2,7-дисульфопроизводным. С динитробензолом, тринитротолуолом, пикриновой кислотой флуорен образует молекулярное соединение (tпл пикрата 80–82 °C).
Применение и получение
Флуорен содержится в каменноугольной смоле (1,3–2 %); выделяется из её антраценовой фракции (210–308 °C) кристаллизацией с последующей перекристаллизацией из бензина. Препаративные способы получения – пиролиз ацетилена, пропускание паров дифенилметана через раскалённую трубку.
Флуорен – исходный продукт для получения красителей, стабилизатор полимеров. Монокристаллы флуорена применяют для изготовления сцинтилляционных счётчиков.