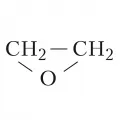
Оксиран
Оксира́н (этиленоксид, 1,2-эпоксиэтан), простейший представитель эпоксидов. Бесцветный газ с характерным эфирным запахом; tкип 10,7 °C; хорошо растворяется в воде, спирте, эфире, углеводородах; горюч, смеси с воздухом (3–80 % по объёму этиленоксида) взрывоопасны. При нагревании до 300 °C устойчив, свыше 400 °C в смеси с N2 изомеризуется в ацетальдегид или образует этилен (при избытке этиленоксида); при окислении О2 в водном растворе AgNO3 образуется гликолевая кислота, при гидрировании над Ni – этанол. Для этиленоксида характерны реакции с размыканием цикла, что используют для гидроксиэтилирования органических соединений. Гидратация этиленоксида в присутствии катализаторов приводит к этиленгликолю. При взаимодействии этиленоксида с галогеноводородами образуются галогенгидрины; со спиртами при нагревании – целлозольвы, карбитолы или эфиры полигликолей. Этиленоксид легко реагирует с HCN в присутствии щелочей, образуя этиленциангидрин, при дегидратации которого получают акрилонитрил. Реакции этиленоксида с органическими кислотами или их ангидридами приводят к моно- и диэфирам этиленгликоля; с альдегидами и кетонами – к циклическим ацетатам или кеталям. Этиленоксид взаимодействует с ароматическими углеводородами по реакции Фриделя – Крафтса. Циклоолигомеризацией этиленоксида получают краун-эфиры. При димеризации этиленоксида образуется 1,4-диоксан. Этиленоксид легко полимеризуется, с пропиленоксидом и полиэтилентерефталатом образует блоксополимеры.
Получают прямым окислением этилена кислородом (катализатор Ag; основной метод), дегидрохлорированием этиленхлоргидрина, эпоксидированием этилена. Этиленоксид – один из важнейших продуктов основного органического синтеза. Применяется в производстве этиленгликоля, галогенгидринов, этаноламинов, диоксана, фенилэтанола, полиэтиленгликолей, неионогенных ПАВ, полиуретанов и др., как бактерицидное средство. Высокотоксичен, обладает канцерогенным и мутагенным действием.