Ретровирусы
Ретрови́русы (Retroviridae), семейство вирусов порядка Ortervirales. Содержат РНК в качестве генетического материала, но при заражении клеток образуют двухцепочечную ДНК-копию своего генома. Ретровирусы вызывают серьёзные заболевания человека, такие как синдром приобретённого иммунодефицита (СПИД) и Т-клеточный лейкоз у взрослых.
История открытия ретровирусов
Одно из первых открытий, связанных с ретровирусами, было сделано американским учёным Фрэнсисом Пейтоном Раусом в 1911 г. Он идентифицировал вирус саркомы Рауса, ретровирус, вызывающий рак у кур. В 1950-х гг. американский вирусолог Шарлотта Френд и польско-американский генетик Людвик Гросс обнаружили ретровирусы, вызывающие лейкоз у мышей.
Прорыв в исследовании ретровирусов произошёл в 1970 г., когда американский генетик Г. Темин и американский биохимик, молекулярный биолог и вирусолог Дэвид Балтимор, работавшие с вирусом саркомы Рауса, независимо друг от друга открыли фермент обратную транскриптазу. Это открытие было удостоено Нобелевской премии по физиологии и медицине в 1975 г.
В 1980-х гг., на заре эпидемии ВИЧ/СПИДа, исследователи определили вирус иммунодефицита человека (ВИЧ) как возбудитель. ВИЧ стал первым обнаруженным ретровирусом человека. В то же время американский учёный Роберт Галло обнаружил вирус Т-клеточного лейкоза человека типа 1 (HTLV-1). HTLV-1 – ещё один ретровирус, связанный с конкретным типом рака – Т-клеточным лейкозом взрослых.
В начале 21 в. исследования ретровирусов нашли применение в генной терапии и генной инженерии, благодаря своей способности интегрировать провирусы в геномы клеток-хозяев.
Классификация ретровирусов
К ретровирусам относятся 2 подсемейства: Orthoretrovirinae и Spumaretrovirinae. Их отличительной особенностью является способность к обратной транскрипции РНК в ДНК. Обратная транскрипция у Spumaretrovirinae происходит до освобождения вирионов из поражённой клетки, а у Orthoretrovirinae – после проникновения вируса в клетку.
Подсемейство Orthoretrovirinae
Orthoretrovirinae включает в себя 6 родов, которые, кроме вирусов иммунодефицита, получили название в соответствии с буквами греческого алфавита.
Альфаретровирусы (Alpharetrovirus) вызывают злокачественные опухоли у птиц; насчитывают 9 видов, например вирус лейкоза птиц (Avian leukosis virus) и вирус саркомы Рауса.
Бетаретровирусы (Betaretrovirus) поражают мышей, овец и некоторых приматов; известно 5 видов, в том числе вирус опухоли молочных желёз мышей (Mouse mammary tumor virus).
Гаммаретровирусы (Gammaretrovirus) являются причиной саркомы, лейкоза и иммунодефицита у кошачьих, рептилий и птиц; самый многочисленный род ретровирусов, включающий 16 видов, например вирус лейкоза мышей (Murine leukemia virus), вирус лейкемии кошек (Feline leukemia virus) и вирус саркомы кошек (Feline sarcoma virus).
Представители дельтаретровирусов (Deltaretrovirus) могут вызывать лейкоз крупного рогатого скота, к ним относятся 4 вида: вирус лейкоза крупного рогатого скота (Bovine leukemia virus) и 3 типа вируса Т-клеточного лейкоза приматов.
Эпсилонретровирусы (Epsilonretrovirus) обитают в воде, известно 3 вида. Поражают рыб, вызывая у них саркому [вирус дермальной саркомы судака (Walleye dermal sarcoma virus)] и эпидермальную гиперплазию [вирус эпидермальной гиперплазии судака 1 и 2 (Walleye epidermal hyperplasia virus; WEHV-1 и WEHV-2)].
Лентивирусы включают 10 видов и поражают коров, лошадей, коз, представителей семейства кошачьих, обезьян и человека. К примерам лентивирусов относятся вирус иммунодефицита человека 1 (Human immunodeficiency virus 1), вирус висна (Visna virus) и вирус инфекционной анемии лошадей (Equine infectious anemia virus).
Подсемейство Spumaretrovirinae
Подсемейство Spumaretrovirinae имеет уникальную морфологию по сравнению с другими ретровирусами. Под электронной микроскопией они характеризуются «пенящимся» видом с обильными цитоплазматическими вакуолями.
В отличие от большинства представителей ретровирусов геном Spumavirinae представляет собой двухцепочечную ДНК, но также включает обратную транскрипцию как этап жизненного цикла.
Spumaretrovirinae обычно считаются менее патогенными, чем некоторые другие ретровирусы. Для них часто характерны стойкие бессимптомные инфекции у их естественных хозяев, в том числе приматов, не относящихся к человеку, и некоторых других млекопитающих. Известно 4 рода Spumaretrovirinae, включающих по одному виду – Bovispumavirus, Equispumavirus, Felispumavirus, Prosimiispumavirus; и ещё 1 род – Simiispumavirus, насчитывающий 15 видов.
Структура ретровирусов и строение генома
Структура ретровирусов играет ключевую роль в их способности инфицировать клетки-хозяева и персистировать в организме-хозяине.
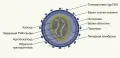
Вирион имеет форму икосаэдра (20-гранника) и диаметр 80−100 нм и состоит из липидной оболочки, капсида, нуклеопротеинового комплекса, обратной транскриптазы, ферментов и РНК-генома.
Наружная липидная оболочка, которой вирус окружает себя при выходе из клетки-хозяина, покрыта ворсинками длиной 8−10 нм.
Капсид ретровирусов состоит из гликопротеинов и имеет 2 субъединицы: поверхностную, которая отвечает за связывание со специфическими рецепторами на поверхности клеток-хозяев, и трансмембранную, которая облегчает слияние мембран вируса и клетки-хозяина. Гликопротеины оболочки ретровирусов сильно гликозилированы, что помогает защитить вирус от иммунной системы хозяина.
Специфические взаимодействия между белками оболочки ретровируса и рецепторами клетки-хозяина определяют тропизм вируса. Ретровирусы могут инфицировать разные типы клеток, например Т-клетки (ВИЧ) или гемопоэтические клетки (ретровирусы, вызывающие лейкемию).
Ретровирусы имеют геном, состоящий из одноцепочечной РНК. Эта молекула РНК несёт всю генетическую информацию, необходимую вирусу для репликации и производства новых вирусных частиц. Таких молекул в вирионе две.
К основным генам ретровирусной РНК относятся: групповой антиген (gag), который кодирует структурные белки, образующие ядро вируса, включая капсид, нуклеокапсид и матричные белки; pol, который кодирует ферменты, необходимые для репликации и обработки вирусного генома, включая обратную транскриптазу, интегразу и протеазу; гены оболочки (env), которые кодируют гликопротеины оболочки, ответственные за связывание с рецепторами клетки-хозяина и опосредование проникновения в клетки-хозяева.
В зависимости от типа ретровируса могут существовать дополнительные гены, выполняющие различные функции, например регуляторные гены, контролирующие экспрессию вирусных генов, или вспомогательные гены, усиливающие репликацию вируса.
Жизненный цикл ретровирусов
Жизненный цикл ретровируса включает связывание вирусной частицы и клетки-хозяина, проникновение вирусного генетического материала, обратную транскрипцию вирусной РНК, интеграцию провирусной ДНК в геном хозяина, транскрипцию и экспрессию генома, сборку вирусных частиц и выход вириона из клетки-хозяина.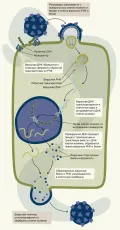 Жизненный цикл ретровирусов (Retroviridae).
Жизненный цикл ретровирусов (Retroviridae).
Жизненный цикл начинается, когда гликопротеины вирусной оболочки связываются со специфическими рецепторами на поверхности клетки-хозяина.
После связывания ретровирус проникает в клетку-хозяина посредством слияния мембран, чему способствуют конформационные изменения белков оболочки.
Попав в клетку-хозяина, геном ретровирусной РНК обратно транскрибируется в ДНК с помощью вирусного фермента обратной транскриптазы. Полученная вирусная кДНК (комплементарная ДНК) образует двухцепочечную молекулу ДНК, известную как провирусная ДНК. Провирусная ДНК транспортируется в ядро клетки-хозяина и с помощью вирусного фермента интегразы интегрируется в геномную ДНК клетки-хозяина. Эндогенные ретровирусы встречаются у разных видов животных, например, известно, что проретровирусы составляют до 5–8 % генома человека.
Интегрированная провирусная ДНК служит матрицей для транскрипции РНК-полимеразой клетки-хозяина. Вирусная РНК может транслироваться рибосомами клетки-хозяина для производства вирусных белков, необходимых для сборки новых вирусных частиц.
Структурные белки ретровирусов, такие как капсидные белки, синтезируются в клетке-хозяине и транспортируются к плазматической мембране, где они собираются с вирусной РНК для образования новых вирусных частиц.
Белки вирусной оболочки встраиваются в мембрану клетки-хозяина и впоследствии отпочковываются от клетки, приобретая при этом липидную оболочку. Высвободившиеся вирусные частицы могут инфицировать другие клетки-хозяева и начать цикл заново.
Простые и сложные ретровирусы
Ретровирусы принято разделять на простые и сложные, отличающиеся друг от друга строением, способностью вызывать разный спектр заболеваний, а также способностью избегать клеточный ответ в организме-хозяине. Простые и сложные ретровирусы имеют сферическую или палочковидную формы.
Простые ретровирусы, такие как вирус саркомы Рауса и вирус лейкоза мышей (Murine leukemia virus), имеют базовую геномную структуру с тремя основными генами (gag, pol, env) и простыми жизненными циклами. Простые ретровирусы часто имеют более ограниченный тропизм, поражая единичные типы клеток внутри своего вида-хозяина.
Сложные ретровирусы, примером которых является ВИЧ, имеют более широкий набор генов. Помимо основных генов gag, pol и env, ВИЧ, например, имеет такие гены, как tat (который кодирует трансактиватор, связанный с клеточными факторами, повышающими эффективность трансляции клеточной РНК-полимеразы, главным образом за счёт преждевременной остановки транскрипции), rev (ген кодирует белок, который связан с удлинением РНК транскриптов и их перемещением из ядра в цитоплазму), nef (ген, который не требуется для репликации вируса в культуре лимфоцитов, но важен для репликации в макрофагах и при развитии болезни, вызванной вирусом иммунодефицита обезьян у макак-резус), vif [ген кодирует белок (фактор инфекционности вирусов), который необходим для некоторых стадий вирусного морфогенеза, связанных с инфекционностью], vpr (способствует созреванию вирусных гликопротеинов в лентивирусах приматов) и vpu (слабый активатор транскрипции в лентивирусах приматов).
Сложные ретровирусы обладают более широким диапазоном клеточного тропизма. Они могут инфицировать различные типы клеток, включая CD4+ Т-клетки, макрофаги, дендритные клетки и др. Они развили механизмы уклонения от иммунных реакций хозяина, например с помощью белка nef. Сложные ретровирусы могут развивать устойчивость к антиретровирусным препаратам за счёт накопления мутаций в различных генах, включая обратную транскриптазу и протеазу.