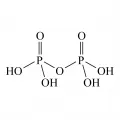
Пирофосфорная кислота
Пирофо́сфорная кислота́ [дифосфорная кислота, гептаоксодифосфат(V) водорода], неорганическая четырёхосновная кислота, полифосфорная кислота, [(HO)2P(O)]2O. Соли и эфиры пирофосфорной кислоты называются пирофосфатами, или дифосфатами. Молярная масса 177,97 г/моль; существует в виде двух кристаллических модификаций с tпл 54,3 и 71,5 °C, смесь плавится при 61 °C.
Физико-химические свойства
Пирофосфорная кислота – бесцветное кристаллическое вещество, растворимое в холодной воде [709 г/100 мл (23 °C)], этаноле, диэтиловом эфире. Гигроскопична.
Образует кристаллогидраты с 1, 5 или 6 молекулами воды.
Показатели констант кислотности (pKa) составляют 0,85 (18 °C), 1,95 (25 °C), 6,68 (25 °C), 9,39 (25 °C).
Пирофосфорная кислота реагирует со щелочами с образованием средних или кислых солей. Вступает в обменные реакции с солями. При кипячении водных растворов переходит в ортофосфорную кислоту. Разлагается при нагревании в вакууме. В расплавах разлагается на смесь, содержащую ортофосфорную кислоту и полифосфорные кислоты с числом атомов фосфора больше двух.
Способы получения
Пирофосфорную кислоту получают медленной кристаллизацией из растворов ортофосфорной кислоты, упаренных до состава H2O:P2O5=2. Она также образуется при взаимодействии ортофосфорной кислоты с оксихлоридом фосфора.
Участие в обмене веществ
Моно- и диэфиры пирофосфорной кислоты широко распространены в природе (например, никотинамидадениндинуклеотид, кофермент А, тиаминпирофосфат, нуклеозиддифосфаты и др.).
Применение
Применение находят производные пирофосфорной кислоты. Пирофосфаты калия и натрия используются в пищевой промышленности как влагоудерживающие агенты (пищевые добавки Е450). Органические пирофосфаты используют в медицине, а также в качестве инсектицидов.