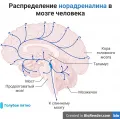
Норадренергическая система
Норадренерги́ческая систе́ма, система взаимосвязанных нейронов мозга, нервных волокон и синапсов, выделяющих катехоламин (норадреналин, НА) в качестве нейромедиатора. Отвечает за развитие центральной нервной системы (ЦНС), модуляцию внимания, адаптацию к стимулам окружающей среды, формирование памяти и извлечение воспоминаний. Наибольшее скопление плотно упакованных норадренергических нейронов находится в голубом пятне головного мозга.
История открытия
 Рис. 1. Расположение голубого пятна в стволе головного мозга (тёмно-серая область).Норадреналин – один из первых идентифицированных нейромедиаторов, обнаруженных в центральной нервной системе шведским физиологом У. фон Эйлером в 1940-х гг. Эксперименты А. Дальстрём и Ч. Фуксе в 1964 г. помогли локализовать основной источник норадреналина в головном мозге – голубое пятно (ядро голубоватого цвета, расположенное с обеих сторон в задней части места соединения моста и среднего мозга) (рис. 1).
Рис. 1. Расположение голубого пятна в стволе головного мозга (тёмно-серая область).Норадреналин – один из первых идентифицированных нейромедиаторов, обнаруженных в центральной нервной системе шведским физиологом У. фон Эйлером в 1940-х гг. Эксперименты А. Дальстрём и Ч. Фуксе в 1964 г. помогли локализовать основной источник норадреналина в головном мозге – голубое пятно (ядро голубоватого цвета, расположенное с обеих сторон в задней части места соединения моста и среднего мозга) (рис. 1).
Эволюция норадренергической системы
Норадреналин относится к биогенным аминам. У животных их продуцируют несколько эволюционно сохранённых ферментов (Moroz. 2021). В организме беспозвоночных норадренергическая передача сигналов отсутствует, аналогичные функции, например стимулирование агрессии и бодрствования у мух, регуляцию частоты сердечных сокращений у кольчатых червей и членистоногих (Bauknecht. 2017), выполняют биогенные амины – октопамин и его предшественник тирамин (Bauknecht. 2017)
С помощью филогенетического анализа и фармакологических методов было установлено, что рецепторы норадреналина, октопамина и тирамина сосуществуют у некоторых морских беспозвоночных (Bauknecht. 2017). У таких первичноротых, как Platynereis dumerilii (вид многощетинковых червей из семейства нереид) и Priapulus caudatus (морские беспозвоночные животные типа приапулид), были идентифицированы и фармакологически охарактеризованы адренергические α1- и α2-рецепторы, которые сосуществуют с рецепторами октопамина α и β, тирамина типов 1 и 2. С эволюционной точки зрения это первые адренергические рецепторы.
У вторичноротых, например у Saccoglossus kowalevskii (тип полухордовые), идентифицированы и охарактеризованы рецепторы как к октопамину α и β, тирамину типов 1 и 2, так и адренергические α1- и α2-рецепторы, указывающие на то, что все 3 сигнальные системы сосуществуют у этого животного.
Учитывая, что все 6 семейств рецепторов (по 2 для октопамина, тирамина и норэпинефрина) можно обнаружить у представителей 2 основных клад билатеральных животных, протосом и дейтеросом, все 6 рецепторов сосуществовали у их последнего общего предка. Адренергические рецепторы были утрачены у большинства насекомых и нематод, а рецепторы тирамина и октопамина – у большинства вторичноротых.
Цикл норадреналина
Цикл норадреналина включает в себя стадии синтеза, хранения, высвобождения, связывания с рецепторами и элиминации (рис. 2).
 Рис. 2. Цикл норадреналина.В мозге норадреналин синтезируется в цитоплазме нейронов задней части гипоталамуса. Для НА, как и для всех катехоламинов, предшественником является L-тирозин – незаменимая аминокислота. Из L-тирозина изначально синтезируется дофамин по следующей схеме: фермент тирозингидроксилаза катализирует гидроксилирование тирозина до L-диоксифенилаланина (L-DOPA), затем фермент декарбоксилаза ароматических аминокислот декарбоксилирует L-DOPA до дофамина. Далее под действием фермента дофамин-бета-гидроксилазы дофамин превращается в норадреналин.
Рис. 2. Цикл норадреналина.В мозге норадреналин синтезируется в цитоплазме нейронов задней части гипоталамуса. Для НА, как и для всех катехоламинов, предшественником является L-тирозин – незаменимая аминокислота. Из L-тирозина изначально синтезируется дофамин по следующей схеме: фермент тирозингидроксилаза катализирует гидроксилирование тирозина до L-диоксифенилаланина (L-DOPA), затем фермент декарбоксилаза ароматических аминокислот декарбоксилирует L-DOPA до дофамина. Далее под действием фермента дофамин-бета-гидроксилазы дофамин превращается в норадреналин.
После синтеза нейромедиатор упаковывается в пресинаптические везикулы и транспортируется к пресинаптическому окончанию для дальнейшего высвобождения, которому предшествует деполяризация пресинаптической плазматической мембраны. Слияние мембран везикул и плазматической мембраны, благодаря чему норадреналин высвобождается и диффундирует через синаптическую щель для активации постсинаптических рецепторов, запускают ионы Ca2+, которые через кальциевые каналы проникают внутрь пресинаптического нейрона. Норадреналин может высвобождаться несинаптическим образом, т. е. путём объёмной передачи, и воздействовать на отдалённые от синаптической щели рецепторы.
Избыточный норадреналин в синаптической щели элиминируется за счёт его обратного захвата либо разрушения.
За контроль нейтротрансмиссии НА отвечает переносчик норадреналина (NET, SLC6A2), представляющий собой встроенный в мембрану белок и в ЦНС экспрессируемый исключительно в пресинаптических нейрональных окончаниях. Он обеспечивает относительно быстрое поглощение норадреналина (примерно 1 молекула в секунду) из синаптической щели в пресинаптические нейронные терминали, где нейромедиатор изолируется в синаптических пузырьках (через везикулярные транспортёры моноаминов, VMAT) для рециркуляции или разложения ферментом моноаминоксидазой.
Катаболизм свободного норадреналина в адренергических окончаниях регулируется ферментом моноаминоксидазой (МАО) в митохондриях и мембранах везикул. Под влиянием МАО происходит окислительное дезаминирование норадреналина. Небольшие количества медиатора подвергаются экстранейрональному захвату эффекторными клетками. В этом случае норадреналин достаточно быстро метаболизируется при участии катехол-О-метилтрансферазы (КОМТ) – происходят о-метилирование медиатора и потеря его активности.
Норадренергические нейроны и их пути
Норадренергические нейроны ЦНС, подобно периферическим симпатическим нейронам, характеризуются диффузно разветвляющейся терминальной аксональной сетью. Центральные нейроны объединяются в 7 отдельных ядер ствола мозга – от А1 (граница продолговатого и спинного мозга) до А7 (в среднем мозге). Эти ядра имеют прямые и обратные связи с корой, подкорковыми образованиями и спинным мозгом. Ядра А1 и А2, также называемые «arousal 1» и «arousal 2», контролируют уровень бодрствования (возбуждения). Ядро А6 является наиболее крупным скоплением норадренергических нейронов и имеет синий цвет за счёт наличия в клетках гранул нейромеланина, поэтому называется голубым пятном. Нейроны голубого пятна широко распространяют свои проекции на большинство областей нервной системы, где они опосредуют двойные эффекты: возбуждение нейронов α1-адренорецепторами и ингибирование α2-адренорецепторами.
Использование методов иммуномаркировки, специфичных для дофамин-β-гидроксилазы (Dbh), фермента, ответственного за превращение дофамина в норадреналин, позволило точно определить локализацию норадренергических нейронов, включая их обширные аксональные проекции. Такие исследования подтвердили, что голубое пятно состоит исключительно из норадренергических нейронов, т. е. является однородной структурой, сложенной плотно упакованной популяцией клеток (у грызунов примерно 1600 клеток). Эти клетки имеют общее эмбриональное происхождение и все вырабатывают норадреналин. Кроме того, популяции норадренергических нейронов демонстрируют синхронные паттерны возбуждения и посылают обширные проекции по всему головному и спинному мозгу для высвобождения норадреналина.
Большинство областей мозга от продолговатого мозга до обонятельной луковицы содержат аксоны нейронов голубого пятна за исключением таких насыщенных аксональными проекциями дофаминовых нейронов или их клеточными телами областей, как полосатое тело, бледный шар, прилежащее ядро и чёрная субстанция. Отсутствие проекций голубого пятна в пределах этих областей предполагает разделение функций между 2 типами катехоламиновых нейронов.
Рецепторы норадреналина
Все функционирующие в ЦНС рецепторы норадреналина являются представителями семейства GPCR (G-protein-coupled receptors), но связаны с разными G-белками:
β-адренорецептор связан с Gs-белком, т. е. при взаимодействии с норадреналином активируется аденилатциклаза, благодаря чему повышается внутриклеточная концентрация циклического аденозинмонофосфата (цАМФ), который в свою очередь активирует цАМФ-зависимую протеинкиназу – протеинкиназу A (рис. 3, а), кроме того, повышается проницаемость плазматической мембраны для ионов калия;
α1-адренорецептор связан с Gq-белком, поэтому при взаимодействии с норадреналином активируется фермент фосфолипаза С, которая далее гидролизует фосфатидилинозитол 4,5-бисфосфат (PIP2) до диацилглицерина (DAG) и инозитолтрисфосфата (IP3). IP3 действует как второй мессенджер для высвобождения запасённого кальция в цитоплазму, в то время как DAG выполняет роль второго мессенджера, который активирует протеинкиназу C (рис. 3, б). При связывании НА с данным типом рецептора также снижается проницаемость для ионов K+;
α2-адренорецептор связан с Gi-белком и действует противоположным образом: деактивирует аденилатциклазу при взаимодействии с норадреналином, что в итоге ведёт к снижению концентрации цАМФ и активности протеинкиназы A (рис. 3, в). Связывание НА с рецептором данного типа приводит к торможению, т. к. дополнительно снижается проницаемость плазматической мембраны для ионов кальция и повышается проницаемость для ионов калия.
 Рис. 3. Механизм действия специфических рецепторов норадреналина.
Рис. 3. Механизм действия специфических рецепторов норадреналина.
Поведенческие эффекты
Норадреналин считается важным регулятором развития мозга (Saboory. 2020). НА экспрессируется на ранних стадиях развития организма и регулирует как рост норадренергических нейронов, так и развитие целевых областей ЦНС.
Высвобождение норадреналина по всему мозгу млекопитающих необходимо для модуляции внимания, возбуждения и познания во время реализации многих видов поведения (Schwarz. 2015).
Норадренергические нейроны стимулируют возбуждение и регулируют состояния бодрствования и сна, возбуждая другие нейроны активирующих и возбуждающих поведенческих цепей и ингибируя нейроны цепей сна (Jones. 2020).
Норадреналин, высвобождаемый из нейронов голубого пятна, участвует в модуляции кодирования, консолидации, извлечения и реверсирования памяти, формирование которой завязано на гиппокампе (Hansen. 2017). Сохранение памяти может быть изменено путём активации голубого пятна и последующего содействия долговременной пластичности гиппокампа в формах долговременной депрессии и долговременного потенцирования.
Норадренергическая система нейронов голубого пятна играет ключевую роль в модуляции зрительного внимания к важным аспектам окружающей среды (Ehlers. 2017). Норадренергические нейроны поэтапно активируются значимыми событиями окружающей среды, включая визуально заметные, новые, имеющие отношение к задаче или эмоционально значимые стимулы, что приводит к высвобождению норадреналина. Такая фазическая активность (ускорение процессов) голубого пятна связана с избирательным вниманием к соответствующим стимулам, следовательно, повышает способность к различению релевантной и нерелевантной информации об окружающей среде, улучшая отношение сигнал/шум для соответствующих стимулов.
Нейроны голубого пятна вместе с другими норадренергическими ядрами модулируют вегетативные функции путём проекций на преганглионарные симпатические и парасимпатические нейроны.
Голубое ядро также модулирует воздействие света на физиологические функции (фотомодуляция). Фотостимуляция возбуждения нейронами голубого пятна позволяет ночным животным функционировать в дневное время.
Нарушение передачи сигналов, опосредованных норадреналином, тесно связано с некоторыми психиатрическими и нейродегенеративными расстройствами у людей (Schwarz. 2015), в частности тревожностью и депрессией, что предполагает участие нейронов голубого пятна в этих состояниях (Gold. 2015). Дисфункция голубого пятна также сильно коррелирует с развитием болезни Альцгеймера, болезни Паркинсона и рассеянного склероза, при которых норадренергические нейроны подвергаются селективной и ранней дегенерации (Schwarz. 2015).