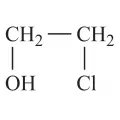
Этиленхлоргидрин
Этиленхлоргидри́н (2-хлорэтанол, β-хлорэтиловый спирт, хлоргидрин этиленгликоля), хлорорганическое соединение, НОСН2СН2Сl. Молярная масса 80,51 г/моль. Впервые получен Ш. Вюрцем в 1859 г.
Физико-химические свойства
Бесцветная малоподвижная жидкость с приятным эфирным запахом; tпл 67,5 °С, tкип 128,7 °С; давление пара (кПа) 0,13 (–4 °С), 0,67 (19 °С), 53,32 (110 °С). Смешивается с водой, спиртами, эфирами в любых соотношениях, образует азеотропные смеси с водой (42,3 % по массе этиленхлоргидрина, tкип 97,8 °С), толуолом и циклогексаном. Взрыво- и пожароопасный продукт, tвсп 55 °С, tвоспл (в закрытом приборе) 58,9 °С, tсамовоспл 425 °С.
Этиленхлоргидрин вступает в реакции, характерные как для спиртов, так и для галогензамещённых углеводородов. При нагревании с водой в присутствии щелочных агентов легко гидролизуется до этиленгликоля. При окислении HNO3 или СrО3 превращается в СlСН2СООН; при кипячении с небольшим количеством концентрированной H2SO4 – в (СlСН2СН2)2О, при этерификации карбоновыми кислотами RCOOH – в RCOOCH2CH2Cl; с алкоголятами образует моноэфир этиленгликоля; при действии гидроксидов Са, Na, Ва – этиленоксид; с водным NH3 – смесь моно-, ди- и триэтаноламинов. С первичными и вторичными аминами образует производные этаноламинов, например:
С солями щелочных металлов при повышенной температуре этиленхлоргидрин вступает в реакции обмена атома Сl (реакция с нитрилами идёт в присутствии каталитических количеств CuCN), хлорируется при 50–90 °С в жидкой фазе с образованием хлораля (в присутствии воды выход хлораля увеличивается).
Способы получения
Этиленхлоргидрин получают из этилена; реакцию проводят при 60–80 °С при непрерывной подаче этилена и хлора в 8–10%-ный водный раствор этиленхлоргидрина (в процессе реакции образуется НСlО, которая и реагирует с этиленом); раствор концентрируют (до 25–30 %), добавляют NaCl, который вызывает его расслоение. Органический слой, содержащий 70 % этиленхлоргидрина, ректифицируют; сначала отделяется азеотропная смесь, затем безводный этиленхлоргидрин.
Этиленхлоргидрин может быть получен взаимодействием этиленгликоля с НСl или S2Cl2 либо реакцией этиленоксида с НСl.
Применение
Водный раствор этиленхлоргидрина – антифриз; безводный этиленхлоргидрин – растворитель эфиров целлюлозы, применяемых в лакокрасочной и других отраслях промышленности. Этиленхлоргидрин может использоваться для получения этиленгликоля и его производных, этаноламинов; для производства этиленоксида утратил своё значение.
Этиленхлоргидрин сильно действует на нервную систему и обмен веществ, раздражает слизистые оболочки. ПДК в воздухе рабочей зоны – 0,5 мг/м3.