Тромбоциты человека при кровопотере
Тромбоци́ты челове́ка при кровопоте́ре, совокупность механизмов активации тромбоцитов и их реакций, направленных на сохранение жизни посредством препятствования кровопотере.
Основная функция тромбоцитов человека (кровяных пластинок) – предотвращение кровопотери (Platelet morphology ... 2021). В сосудах пластинки располагаются вблизи эндотелия, это позволяет им обеспечивать мониторинг состояния сосудистой стенки и при её повреждении запускать процесс активации (Determination of surface-induced platelet activation by applying time-dependency dissipation factor versus frequency using quartz crystal microbalance with dissipation. 2011; Этот загадочный тромбоцит. 2014). Как показано на микрофотографии в работе Ж. Фатисона и др. Determination of surface-induced platelet activation by applying time-dependency dissipation factor versus frequency using quartz crystal microbalance with dissipation (2011), специальные методы сканирующей электронной микроскопии с фотографированием позволяют проследить процесс распластывания активированного тромбоцита по поверхности (а–г). Пластинки в результате стимуляции проявляют выраженную адгезию, агрегацию и последующую секрецию содержимого гранул (Platelets ... 2019). Обнаружив повреждённый участок сосуда, пластинки прикрепляются в этом месте к его стенке, проявляя свои адгезивные свойства, а затем и друг к другу, демонстрируя способность к агрегации. Степень их агрегации зависит и от содержания в плазме фибриногена и мономеров фибрина (Марковчин. 2014).
Механизмы активации тромбоцитов человека
Существует множество механизмов активации кровяных пластинок и факторов, которые стимулируют этот процесс. Главный среди них – коллаген, присутствующий, например, в субэндотелии или средней оболочке сосудов. Однако кроме коллагена кровяные пластинки могут активироваться некоторыми метаболитами, присутствующими в эндотелиальных клетках при их повреждении, например аденозиндифосфорной кислотой (АДФ) (Бабичев. 2013; Gardiner. 2014). Предполагается, что после связывания с агонистом на мембране кровяной пластинки запускается стандартный каскад реакций с участием вторичных мессенджеров (Савченко. 2009; Якименко. 2014). Это приводит к появлению в их цитоплазме инозитолтрифосфата, который индуцирует выход ионов кальция из депо, что, в свою очередь, стимулирует дегрануляцию и, как следствие этого, запуск процессов адгезии и последующей агрегации пластинок (Физиологические функции .... 2011). Параллельно с этими процессами в плазме крови (при повреждении стенки сосуда) появляются ещё несколько факторов, стимулирующих процессы свёртывания крови: тромбин, тромбоксан А2 и АДФ. При свёртывании крови основные количества тромбина образуются из протромбина с участием мембран активированных кровяных пластинок (Добровольский. 2013). Из компонентов арахидоновой кислоты, входящей в состав мембраны кровяных пластинок, образуется тромбоксан А2, стимулирующий их агрегацию и являющийся вазоконстриктором. Взаимодействие этих трёх факторов с рецепторами на мембране пластинок также приводит к появлению инозитолтрифосфата и, соответственно, выбросу кальция. Дабы избежать беспричинной активации кровяных пластинок, нативный эндотелий постоянно секретирует незначительные количества оксида азота(II) и простациклина, препятствующих их активации (Физиологические функции .... 2011). Такой эффект простациклина опосредован синтезом некоторых циклических нуклеотидов, и в первую очередь циклического аденозинмонофосфата (цАМФ), который вызывает резкое падение концентрации ионов кальция в цитоплазме. В запуске процессов активации пластинок за счёт АДФ активную роль играют и пуриновые рецепторы, стимуляция которых способна изменять структуру рецепторов фибриногена [гликопротеина IIB/IIIA (GPIIB/IIIA)] (Бакунович. 2017; Пантелеев. 2014). Усреднённый вариант участия кровяных пластинок в процессе свёртывания крови показан на рисунке.
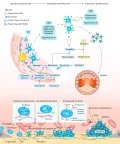 Схематическое изображение адгезии, активации и агрегации кровяных пластинок.Электростатические взаимодействия в активации кровяных пластинок
Схематическое изображение адгезии, активации и агрегации кровяных пластинок.Электростатические взаимодействия в активации кровяных пластинок
Определённую роль в активации кровяных пластинок играют и электростатические взаимодействия (Fernández-Delgado. 2012), т. к. в зоне повреждения сосуда заряд его внутренней стенки с минуса меняется на плюс. Кровяные пластинки после их активации несут на своей поверхности отрицательный заряд за счёт появления фосфатидилсерина, поэтому они электростатически в течение 3–10 с «прилипают» к травмированному участку. С фосфатидилсерином при участии ионов кальция связываются некоторые факторы свёртывания, образуя комплексы, приводящие к процессам желирования плазмы в месте повреждения (плазменный гемостаз). Таким образом, фосфатидилсерин обеспечивает прокоагулянтную функцию кровяных пластинок (Якименко. 2014).
При активации кровяные пластинки меняют свою морфологию, изменяя конформацию актинового цитоскелета, что сопровождается изменением их формы из дисковидной в шаровидную, с одновременным формированием псевдоподий, изменяющих механизмы движения клеток, тем самым переходя к активированному фенотипу с проагрегационными свойствами (Determination of surface-induced platelet activation by applying time-dependency dissipation factor versus frequency using quartz crystal microbalance with dissipation. 2011; Бакунович. 2017).
Взаимодействие с инфекционными агентами в активации кровяных пластинок
Существует ещё один путь активации кровяных пластинок, который связан с наличием на их мембране толл-подобных рецепторов, способных связываться с бактериальными антигенами. Стимуляция этих рецепторов, наряду с антибактериальными реакциями, также приводит к запуску агрегации пластинок (Тромбоциты, как активаторы ... 2019; McFadyen. 2018).
Всё это свидетельствует о нескольких альтернативных вариантах активации кровяных пластинок при повреждении целостности сосудов, что повышает надёжность запуска этих процессов. Следует отметить, что вся система гемостаза даже при крупных травмах изначально рассчитана на максимально долгое поддержание мозгового кровообращения.
