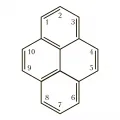
Пирен
Пире́н, полициклический ароматический углеводород, содержащий 4 конденсированных бензольных кольца, C16H10. Образуется при неполном сгорании органических соединений. Содержится в антраценовой фракции каменноугольной смолы (до 5,4 % по весу). Токсичен, раздражает кожу, слизистые оболочки глаз и верхних дыхательных путей. Молярная масса 202,26 г/моль.
Физико-химические свойства
Пирен – светло-жёлтое кристаллическое вещество, растворимое в этаноле [1,37 г/100 г (16 °C), 3,08 г/10 г (tкип)], толуоле [16,54 г/100 г (18 °C)], сероуглероде, диэтиловом эфире, бензоле, хлороформе, нерастворимое в воде. Плотность 1,277 г/см3 (при 0 °C), 1,271 г/см3; tпл 149–150 °C (с возгонкой); tкип 392 °C.
Как в твёрдом виде, так и в растворе пирен обладает голубой флуоресценцией.
Вступает в реакции, характерные для ароматических углеводородов. Хромовой смесью окисляется в 1,6- и 1,8-пиренхиноны и далее в перинафтенон и нафталин-1,4,5,8-тетракарбоновою кислоту. Гидрирование пирена даёт различные продукты в зависимости от условий реакции и катализатора: 4,5-дигидро- и 4,5,9,10-тетрагидропирены (сернисто-молибденовый катализатор), 1,2,3,6,7,10-гексагидропирен (никелевый катализатор). Электрофильное замещение в молекуле пирена происходит прежде всего в положении 1, затем в 3, 6, 8. Легко образуются 1-хлор-, 1-бром-, 1-нитро-, 1-сульфо- и 1-альдегидопроизводные. Дальнейшее замещение даёт 1,6- и 1,8-дизамещённые, 1,3,6-тризамещённые, 1,3,6,8-тетразамещённые пирены. Пирен присоединяет литий (в эфирном растворе), реакция полученного производного с углекислым газом даёт 1,8-дигидропиренкарбоновую кислоту.
Озонолиз пирена позволяет получать замещённые производные фенантрена.
Способы получения
Пирен выделяют из каменноугольной смолы. Он образуется также при крекинге нефти и при гидрогенизации гудрона под высоким давлением.
Применение
Пирен используется в производстве красителей, оптических отбеливателей, пестицидов, нафталин-1,4,5,8-тетракарбоновой кислоты; монокристаллы пирена применяют для изготовления сцинтилляционных счётчиков.