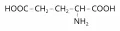Глутаматергическая система
Глутаматерги́ческая систе́ма, общая возбуждающая система мозга, представленная совокупностью нейронов, нервных волокон и синапсов, синтезирующих и выделяющих дикарбоновую аминокислоту глутамат (L-глутаминовую кислоту) в качестве возбуждающего нейромедиатора.
История открытия
Впервые предположение о возбуждающем действии глутамата в головном и спинном мозге млекопитающих выдвинул Хаяси Такаси в 1952 г. В 1970-е гг. научное сообщество признало роль глутамата как основного нейромедиатора в центральной нервной системе (ЦНС), в то же время было высказано предположение, что глутамат постсинаптически действует на 3 семейства ионотропных рецепторов. В конце 1980-х гг. была сформулирована гипотеза о существовании метаботропных рецепторов глутамата, связанные с G-белком.
Эволюция глутаматергической системы
Глутамат функционирует в качестве нейромедиатора у всех животных, имеющих нервную систему (Zhiheng Gou. 2012), включая гребневиков, у которых не было обнаружено таких повсеместно распространённых нейромедиаторов, как серотонин и ацетилхолин.
Происхождение коммуникаций, опосредованных глутаматом, может быть прослежено до первичных путей метаболизма азота и углерода. Структурные, физические и химические параметры глутамата предоставили дополнительные возможности для его оппортунистического привлечения как в биохимические, так и в сигнальные пути (Young. 2000).
В условиях осмотического стресса внутриклеточные концентрации глутамата могут увеличиваться до 250–300 мМ, вследствие чего ещё на ранних этапах эволюции возникала потребность в его гомеостазе, компартментализации и идентификации. Кроме того, вызывавшая стресс «утечка» глутамата во время различных метаболических, пищевых, репродуктивных процессов вместе с полярной (анионной) природой этой аминокислоты создали условия для предварительной адаптации, или экзаптации, к будущему отбору глутамата в качестве идеальной молекулы для межклеточной коммуникации (Evolution of glutamatergic signaling and synapses ... 2021). Все это, по-видимому, привело к развитию модульных молекулярных систем для быстрой фиксации глутамата у бактерий и архей в ходе эволюции.
Рецепторы к глутамату могли существовать ещё до разделения животных и растений, о чём свидетельствует наличие у растений своего рода глутаматных рецепторов, структура которых очень похожа на ионотропные глутаматные рецепторы животных.
Многоклеточные организмы, не имеющие нервной системы (губки, пластинчатые), используют глутамат для передачи сигналов между клетками и обладают собственными рецепторами глутамата (Evolution of glutamatergic signaling and synapses ... 2021).
Стрекающие являются первыми животными, обладающими как «истинными» НМДА-рецепторами глутамата (N-метил-D-аспартат; N-methyl-D-aspartate receptor, NMDA), так и специфичными НМДА-подобными рецепторами (Metazoan evolution of glutamate receptors ... 2018). Среди беспозвоночных наиболее подробно изучена передача сигналов посредством глутамата у представителей всего трёх групп организмов: Caenorhabditis elegans (нематоды), Drosophila (членистоногие) и Aplysia (моллюски). Каждая из этих нейробиологических моделей представляет различные аспекты функций глутамата в нервной системе: идентичность нейронов и организацию цепей (нематоды), нервно-мышечную передачу (членистоногие), обучение и память (брюхоногие и головоногие моллюски).
Показано, что ЦНС беспозвоночных содержит около 10 % (или менее) глутаматергических нейронов (остальные нейроны используют другие нейромедиаторы), что контрастирует с чрезмерной представленностью глутаматергических нейронов в ЦНС позвоночных. Кроме того, у большинства изученных беспозвоночных глутамат часто действует как ингибирующий нейромедиатор (Aplysia cys-loop ... 2009), что было утрачено в ходе эволюции у позвоночных.
С эволюционной точки зрения, для млекопитающих оказалось выгодным иметь глутамат в качестве основного возбуждающего нейромедиатора, так как после высвобождения он может использоваться в качестве энергетического ресурса (например, в астроцитах), помогая поддерживать большее количество активированных нейронов или привлекать больше синапсов/клеток для многозадачной работы сложного мозга.
Цикл глутамата
Цикл глутамата включает в себя стадии синтеза, хранения, высвобождения, связывания с рецепторами и элиминации (см. рис. 1).
 Рис. 1. Цикл глутамата.Глутамат, попадающий в организм с пищей, не оказывает никакого влияния на работу мозга, так как не способен самостоятельно проникать через гематоэнцефалический барьер (ГЭБ). При этом аминокислота активно выводится из нервной системы через ГЭБ с помощью высокоаффинной транспортной системы, которая поддерживает концентрацию нейромедиатора в жидкостях мозга на постоянном уровне.
Рис. 1. Цикл глутамата.Глутамат, попадающий в организм с пищей, не оказывает никакого влияния на работу мозга, так как не способен самостоятельно проникать через гематоэнцефалический барьер (ГЭБ). При этом аминокислота активно выводится из нервной системы через ГЭБ с помощью высокоаффинной транспортной системы, которая поддерживает концентрацию нейромедиатора в жидкостях мозга на постоянном уровне.
Глутамат образуется в клетках организма путём трансаминирования с затратой никотинамидадениндинуклеотидфосфата (НАДФ) из α-кетоглутарата, который образуется в цикле Кребса. При трансаминировании аминогруппа переносится с аланина или аспартата на α-кетоглутарат, заменяя кетоновый радикал. В ЦНС глутамат также синтезируется из глутамина митохондриальным ферментом глутаминазой в пресинаптическом нейроне либо в соседних глиальных клетках (в частности, в астроцитах).
В глутаматергических пресинаптических терминалях синтезированный глутамат переносится в синаптические пузырьки с помощью протон-сопряжённого транспорта: в везикулу с помощью протон-зависимой АТФазы закачиваются ионы водорода, при выходе протонов по градиенту в везикулу поступают молекулы глутамата при помощи везикулярного транспортёра глутамата (vesicular glutamate transporter, VGLUT), работа которого никак не зависит от ионов калия и натрия (Zhou. 2014). Считается, что концентрация глутамата в везикуле составляет около 100 ммоль/л, чего уже достаточно для возникновения потенциала действия. Глутамат высвобождается из везикул в пресинаптических окончаниях по кальций-зависимому механизму. После высвобождения нейромедиатора синаптические пузырьки перерабатываются для повторного использования в процессе синаптической передачи (Hori. 2012).
Глутаматергические нейроны и их пути
В ЦНС млекопитающих и, в частности, человека находится порядка 106 глутаматергических нейронов. Тела этих нейронов лежат по большей части в коре головного мозга, обонятельной луковице, гиппокампе, чёрной субстанции и мозжечке.
Рецепторы глутамата
Высвобождённый глутамат может связываться с большим разнообразием рецепторов (табл.), среди которых как ионотропные [NMDA-R, АМРА-R, каинатные рецепторы (КА)], так и метаботропные.
Специфические рецепторы глутамата
Рецепторы (гены) | Тип рецептора и эффект | Локализация |
NMDA-R (NR1, NR2A-NR2D, NR3A-NR3B) | Ионотропные ↑Ca2+, ↑Na+, ↓K+ Возбуждающий ответ медленно нарастает и медленно спадает | Широко распространены по всей ЦНС |
АМРА-R (GluR1-GluR4) | Ионотропные ↑Ca2+, ↑Na+ Возбуждающий ответ резко нарастает и резко спадает | Гиппокамп, наружные слои коры переднего мозга, базальные ганглии, обонятельные доли, миндалевидное тело
|
Каинатные (GluR5-GluR7, KA1-KA2) | Ионотропные ↑Na+, ↓K+ Возбуждающий ответ несколько медленнее, чем у AMPA-R | Более ограниченное распространение в головном мозге по сравнению с рецепторами AMPA-R
|
Рецепторы группы I [mGlu-R1 (a, b, c, d); mGlu-R5 (a, b)] | Метаботропные (Gq) ↑Na+, ↑K+ ↓GLU
| Гиппокамп, мозжечок, кора больших полушарий головного мозга |
Рецепторы группы II Gi/Go (mGlu-R2, mGlu-R3) | Метаботропные (Gi/Go)
| |
Рецепторы группы III Gi/Go [mGlu-R4 (a, b), mGlu-R6, mGlu-R7 (a, b), mGlu-R8 (a, b, c)] | Метаботропные (Gi/Go)
|
Ионотропные глутаматные рецепторы представляют собой интегральные мембранные белки, состоящие из четырёх крупных субъединиц (более 900 аминокислотных остатков), которые образуют пору центрального ионного канала.  Рис. 2. Механизм действия специфических рецепторов глутамата.Функциональные рецепторы AMPA и KA могут быть гомо- или гетеромерными тетрамерами, тогда как НМДА-рецепторы являются облигатными гетеромерами (Huettner. 2015). Стимуляция ионотропных рецепторов приводит к выходу ионов калия из клетки и поступлению внутрь клетки ионов кальция и натрия, в результате чего постсинаптический нейрон возбуждается и возникает потенциал действия (рис. 2, а).
Рис. 2. Механизм действия специфических рецепторов глутамата.Функциональные рецепторы AMPA и KA могут быть гомо- или гетеромерными тетрамерами, тогда как НМДА-рецепторы являются облигатными гетеромерами (Huettner. 2015). Стимуляция ионотропных рецепторов приводит к выходу ионов калия из клетки и поступлению внутрь клетки ионов кальция и натрия, в результате чего постсинаптический нейрон возбуждается и возникает потенциал действия (рис. 2, а).
Метаботропные рецепторы глутамата действуют через систему G-белков, модулируя синаптические передачу и нейропластичность по всей ЦНС (Young Ho Suh. 2018). Данные рецепторы состоят из 7 трансмембранных доменов, соединённых 3 внеклеточными и 3 внутриклеточными петлями. N-концевой внеклеточный домен содержит глутаматсвязывающий домен и домен, богатый цистеином. Цитоплазматический С-концевой домен модулирует передачу сигналов рецептора, транспорт и связывание с G-белком. Этот регион является основной мишенью фосфорилирования белка и центром межбелковых взаимодействий. Рецепторы группы I (mGlu1 и mGlu5) связаны с Gq-подобными белками и стимулируют фосфолипазу C, что приводит к повышению уровня внутриклеточных ионов Ca2+ и активации протеинкиназы C (рис. 2, б). Рецепторы группы II (mGlu2 и mGlu3) и группы III (mGlu4, mGlu6, mGlu7 и mGlu8) связаны с белками Gi/Go и ингибируют аденилатциклазу, что приводит к уменьшению циклического аденозинмонофосфата (цАМФ) и инактивации протеинкиназы A (рис. 2, в).
Активируемые глутаматом пресинаптические глутаматные рецепторы могут контролировать высвобождение глутамата в синаптическую щель (ауторецепторы) либо модулировать высвобождение других медиаторов, например, гамма-аминомасляной кислоты (ГАМК), глицина, или ацетилхолина (гетерорецепторы). Глутамат посредством объёмной передачи может также оказывать своё действие за пределами синапса, взаимодействуя с рецепторами, которые расположены экстрасинаптически.
Избыток глутамата удаляется из синаптической щели с помощью транспортёров возбуждающих аминокислот (excitatory amino acid transporter, EAAT) и далее поступает либо в пресинаптическую мембрану (менее используемый путь), либо в астроциты, которые превращают захваченный глутамат в глутамин под воздействием глутаминсинтетазы и высвобождают его во внеклеточное пространство. Глутамин попадает в пресинаптические терминали и метаболизируется в глутамат фосфат-активируемой глутаминазой.
При нарушениях работы головного мозга глутаматовые транспортёры EAAT и VGLUT часто перестраивают свою работу в обратном направлении так, что избыток глутамата может накапливаться вне клеток. Этот патологический процесс ведёт к возникновению эксайтотоксичности путём усиления проникновения ионов кальция в клетки через каналы НМДА-рецепторов, что в итоге и приводит к повреждению нейронов и возможной гибели клеток (Lau. 2010).
Глутамат при помощи митохондриального фермента глутаматдегидрогеназы может деградировать до α-кетоглутарата и аммиака. Кроме того, глутамат служит метаболическим предшественником нейромедиатора ГАМК, который образуется под действием фермента глутаматдекарбоксилазы.
Поведенческие эффекты
Благодаря своей вовлечённости в синаптическую пластичность глутамат участвует в когнитивных функциях, таких как обучение и память. Форма нейропластичности, известная как долгосрочное потенцирование, ассоциирована именно с глутаматергическими синапсами в гиппокампе, неокортексе и других частях мозга. Путём связывания с экстрасинаптическими рецепторами глутамат регулирует возбудимость нейронов и синаптическую силу путём вовлечения астроглии, дополнительно способствует улучшению когнитивных функций, а также участвует в регуляции цикла сон – бодрствование. Кроме того, глутамат играет важную роль в регуляции роста колбочек и синаптогенеза во время развития мозга.