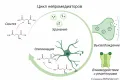
Цикл нейромедиаторов
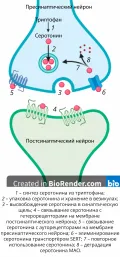 Цикл серотонина.Цикл нейромедиа́торов, последовательность этапов существования нейромедиаторов, начиная с их синтеза в нейроне и заканчивая элиминацией из синаптической щели.
Цикл серотонина.Цикл нейромедиа́торов, последовательность этапов существования нейромедиаторов, начиная с их синтеза в нейроне и заканчивая элиминацией из синаптической щели.
Молекулярные механизмы работы нейромедиаторов можно объединить в общую схему: синтез → хранение → высвобождение → взаимодействие с рецептором → элиминация. Достаточно часто продукты элиминации вновь используются нейроном для синтеза нейромедиаторов, поэтому цикл в отдельных случаях является замкнутым.
Синтез
Нейромедиаторы, как правило, синтезируются в нейронах из большого количества молекул-предшественников. Синтез зависит от класса нейромедиатора (аминокислоты, моноамины, пептиды, пурины и др.).  Схема синтеза серотонина.Моноамины синтезируются из одной аминокислоты: серотонин из триптофана (Serotonin in animal cognition and behavior. 2020), дофамин из L-диоксифенилаланина (L-ДОФА) (Dopamine ... 2018), гистамин из гистидина (Panula. 2021) и т. д. Некоторые аминокислоты сами по себе являются нейротрансмиттерами, например глицин (Multifarious beneficial effect ... 2017), глутамат (Glutamate metabolism ... 2021). Нейропептиды образуются из длинных полипептидных предшественников (нередко при протеолизе одного предшественника высвобождается сразу несколько активных нейропептидов). Пуриновые нейротрансмиттеры, например аденозинтрифосфат (АТФ), получаются из нуклеиновых кислот. Некоторые нейромедиаторы состоят из продуктов метаболизма (например, оксид азота).
Схема синтеза серотонина.Моноамины синтезируются из одной аминокислоты: серотонин из триптофана (Serotonin in animal cognition and behavior. 2020), дофамин из L-диоксифенилаланина (L-ДОФА) (Dopamine ... 2018), гистамин из гистидина (Panula. 2021) и т. д. Некоторые аминокислоты сами по себе являются нейротрансмиттерами, например глицин (Multifarious beneficial effect ... 2017), глутамат (Glutamate metabolism ... 2021). Нейропептиды образуются из длинных полипептидных предшественников (нередко при протеолизе одного предшественника высвобождается сразу несколько активных нейропептидов). Пуриновые нейротрансмиттеры, например аденозинтрифосфат (АТФ), получаются из нуклеиновых кислот. Некоторые нейромедиаторы состоят из продуктов метаболизма (например, оксид азота).
Хранение
После синтеза нейромедиаторы упаковываются в синаптические везикулы, расположенные вблизи клеточной мембраны пресинаптического нейрона. Исключением являются метаболические газы (монооксид углерода и оксид азота), которые синтезируются и сразу высвобождаются, как только возникает потенциал действия, и не накапливаются в везикулах (Sanders. 2019).
Высвобождение
Возникновение потенциала действия в пресинаптическом нейроне, как правило, приводит к высвобождению нейромедиатора в синаптическую щель. Однако существует базовый уровень высвобождения нейромедиатора без электрической стимуляции. Нейромедиаторы высвобождаются в синаптическую щель при слиянии везикулы с мембраной пресинаптического нейрона, после чего они диффундируют к специфическим рецепторам.
Взаимодействие с рецепторами
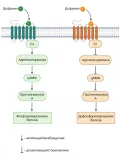 Процессы, запускаемые дофамином внутри клетки при связывании со специфическими рецепторами.Нейромедиаторы высвобождаются и диффундируют через синаптическую щель, где они связываются со специфическими рецепторами на мембране постсинаптического нейрона (иногда медиатор может связываться с рецепторами на пресинаптическом нейроне и оказывать влияние, соответственно, на него) (Elias. 2005).
Процессы, запускаемые дофамином внутри клетки при связывании со специфическими рецепторами.Нейромедиаторы высвобождаются и диффундируют через синаптическую щель, где они связываются со специфическими рецепторами на мембране постсинаптического нейрона (иногда медиатор может связываться с рецепторами на пресинаптическом нейроне и оказывать влияние, соответственно, на него) (Elias. 2005).
Действие нейромедиатора зависит от количества специфических рецепторов определённого типа, которые на данный момент презентует клетка-мишень в синапсе. С чем большим количеством однотипных рецепторов свяжется медиатор, тем сильнее будет его эффект. В зависимости от рецептора один и тот же нейромедиатор может оказать возбуждающее, тормозящее или модулирующее действие на постсинаптический нейрон.
Элиминация
Для контроля воздействия нейромедиатора на клетку-мишень необходима элиминация – удаление излишков медиатора из синаптической щели. Это позволяет избежать непрерывного и избыточного влияния нейромедиатора и, соответственно, тонко регулировать его действие на целевую клетку. Для удаления нейромедиатора из синаптической щели клетка использует 3 механизма: диффузию, ферментативное расщепление и повторное использование.
Глиальные клетки (в частности, астроциты) поглощают избыток нейромедиатора, внутри их расщепляют ферменты, после чего продукты расщепления вновь поступают в нейроны для синтеза нового медиатора. К примеру, избыток глутамата астроцитарный белок-транспортёр переносит в астроциты. С помощью специального фермента глутаминсинтетазы, который экспрессируется в астроцитах, но не в нейронах, захваченный глутамат превращается в глутамин. Глутамин выделяется в синаптическую щель и поступает в нейроны, где используется для синтеза глутамата с помощью нейронального фермента глутаминазы (Danbolt. 2001; Glutamate metabolism ... 2021). Избыток ацетилхолина расщепляется ферментом ацетилхолинэстеразой на ацетат и холин. Оставшийся холин затем поглощается и перерабатывается пресинаптическим нейроном для синтеза ацетилхолина (Thapa. 2017).
Повторное использование основано на специфических для разных нейромедиаторов механизмах захвата их молекул как самими нейронами, так и клетками нейроглии. В этом процессе участвуют специальные молекулы-транспортёры. Повторно используются в основном моноамины (норадреналин, дофамин, серотонин), глутамат, гамма-аминомасляная кислота (ГАМК), глицин и холин (но не ацетилхолин).
Отдельные аспекты применения в медицине и фармакологии
Действие всех современных распространённых и разрешённых антидепрессантов так или иначе основывается на модуляции нейромедиаторных циклов (Harmer. 2017).
В соответствии с современными рекомендациями для большинства пациентов с глубокой депрессией в качестве первой линии лечения применяются селективные ингибиторы обратного захвата серотонина (СИОЗС). Доступны и другие селективные ингибиторы обратного захвата моноаминов. Более поздние разработки привели к появлению препаратов, которые блокируют обратный захват серотонина, оказывая дополнительное воздействие на различные подтипы серотониновых рецепторов. Кроме того, некоторые антидепрессанты не действуют путём блокады обратного захвата норадреналина и серотонина.
В настоящее время для пациентов с болезнью Альцгеймера доступны только 2 класса фармакологической терапии (Weller. 2018). Ингибиторы холинэстеразы являются рекомендуемой терапией для пациентов с лёгкой, умеренной или тяжёлой деменцией при болезни Альцгеймера, а также деменцией при болезни Паркинсона.
Для лечения шизофрении также используются препараты, действие которых связано с нейромедиаторными циклами (Meltzer. 2017). Например, атипичный нейролептик клозапин блокирует различные рецепторы таких систем, как дофаминергическая, серотонинергическая, ацетилхолинергическая, гистоминергическая и адренергическая, что, вероятно, опосредует его антипсихотический, анксиолетический, антиманиакальный и антидепрессивный эффекты.