Топные отношения
То́пные отноше́ния, характеризуют отношения симметрии определённых частей молекулы, а именно отношения групп (или атомов) и сторон. Две или более идентичных группы в молекуле 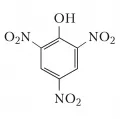 Структурная формула тринитрофенола.могут быть по-разному расположены относительно остальной части молекулы. Так, в пикриновой кислоте (тринитрофенол) нитрогруппы в положениях 2 и 6 одинаково расположены относительно реперного атома C-1, связанного с гидроксильной группой OH (через две связи от C-1), тогда как положения 2 и 4 различны (через две и четыре связи от C-1).
Структурная формула тринитрофенола.могут быть по-разному расположены относительно остальной части молекулы. Так, в пикриновой кислоте (тринитрофенол) нитрогруппы в положениях 2 и 6 одинаково расположены относительно реперного атома C-1, связанного с гидроксильной группой OH (через две связи от C-1), тогда как положения 2 и 4 различны (через две и четыре связи от C-1).
В топных отношениях участвуют только одинаково расположенные идентичные группы. Такие группы могут быть гомотопными (гомотопия), диастереотопными (диастереотопия) и энантиотопными (энантиотопия). Диастереотопные и энантиотопные группы называют гетеротопными.
Гомотопными (эквивалентными) называют группы, взаимозаменяемые благодаря поворотам относительно оси симметрии. Из этого следует, что любая ахиральная или хиральная молекула, имеющая ось симметрии, содержит по крайней мере один набор (обычно пару) гомотопных групп. К соединениям, в которых присутствуют соответственно 2, 3 и 6 гомотопных атома водорода H, относятся метиленхлорид, метилхлорид и бензол.
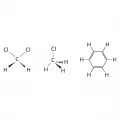 Структурные формулы метиленхлорида, метилхлорида и бензола.Энантиотопными называют группы, которые взаимозаменяются операцией симметрии относительно зеркально-поворотной оси [чаще всего это плоскость (σ = S1) или центр (Сi = S2) симметрии]. Таким образом, энантиотопные группы могут встречаться только в ахиральных молекулах. Энантиотопными являются группы CH2COOH в лимонной кислоте и их части (CH2, COOH) или фенильные и карбоксильные группы в труксилловой кислоте.
Структурные формулы метиленхлорида, метилхлорида и бензола.Энантиотопными называют группы, которые взаимозаменяются операцией симметрии относительно зеркально-поворотной оси [чаще всего это плоскость (σ = S1) или центр (Сi = S2) симметрии]. Таким образом, энантиотопные группы могут встречаться только в ахиральных молекулах. Энантиотопными являются группы CH2COOH в лимонной кислоте и их части (CH2, COOH) или фенильные и карбоксильные группы в труксилловой кислоте.
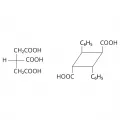 Структурные формулы лимонной и труксилловой кислот.Диастереотопными называют группы, которые нельзя взаимозаменить в результате любой операции симметрии. Поскольку в асимметричных молекулах, таких, как I или II, нет элементов симметрии, геминальные группы в них (соответственно CH3 и H) диастереотопны. Хиральные молекулы с поворотной симметрией (например, III) и ахиральные молекулы (например, IV и V) также могут содержать диастереотопные пары групп, но при этом элемент симметрии не должен относиться к этим группам.
Структурные формулы лимонной и труксилловой кислот.Диастереотопными называют группы, которые нельзя взаимозаменить в результате любой операции симметрии. Поскольку в асимметричных молекулах, таких, как I или II, нет элементов симметрии, геминальные группы в них (соответственно CH3 и H) диастереотопны. Хиральные молекулы с поворотной симметрией (например, III) и ахиральные молекулы (например, IV и V) также могут содержать диастереотопные пары групп, но при этом элемент симметрии не должен относиться к этим группам.
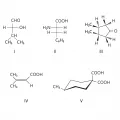 Диастереотопные группы.Диастереотопные группы можно легко различить по их отношению (рядом или удалены) к какой-либо реперной группе. Так, геминальные атомы H в каждой группе CH2 циклопентанона III (группа симметрии C2) диастереотопны, причём один атом Н расположен рядом с соседней метильной группой, а другой – удалён от неё. Молекулы IV и V имеют плоскость симметрии, однако метильная и карбоксильная группы, которые лежат в этой плоскости, не могут быть заменены операцией симметрии относительно неё. Для конформационно подвижных молекул, таких, как I и II, данное взаимоотношение (близко – далеко) между диастереотопными группами справедливо только для определённой конформации; однако молекулярное окружение каждого члена группы различно для каждого конформера. Хотя величина этого различия (выраженная каким-либо физическим параметром, например намагничиванием) зависит от конформационного равновесия, сам факт такого различия нельзя убрать быстрым вращением или инверсией кольца.
Диастереотопные группы.Диастереотопные группы можно легко различить по их отношению (рядом или удалены) к какой-либо реперной группе. Так, геминальные атомы H в каждой группе CH2 циклопентанона III (группа симметрии C2) диастереотопны, причём один атом Н расположен рядом с соседней метильной группой, а другой – удалён от неё. Молекулы IV и V имеют плоскость симметрии, однако метильная и карбоксильная группы, которые лежат в этой плоскости, не могут быть заменены операцией симметрии относительно неё. Для конформационно подвижных молекул, таких, как I и II, данное взаимоотношение (близко – далеко) между диастереотопными группами справедливо только для определённой конформации; однако молекулярное окружение каждого члена группы различно для каждого конформера. Хотя величина этого различия (выраженная каким-либо физическим параметром, например намагничиванием) зависит от конформационного равновесия, сам факт такого различия нельзя убрать быстрым вращением или инверсией кольца.
Более наглядно понятие «топные отношения» может быть представлено с помощью т. н. критерия замещения, заключающегося в умозрительной замене каждой из сравниваемых групп (или атомов) на другую, отличную. Например, при замене любого метиленового атома H в пропане на атом хлора Cl получим одно и то же соединение – 2-хлорпропан. В этом случае говорят о гомотопности метиленовых атомов H. Если при замене каждого из сравниваемых атомов (групп) образуются различные энантиомеры, то такие атомы (группы) являются энантиотопными. Если же использование критерия замещения приводит к различным диастереомерам, то говорят о диастереатопности сравниваемых групп или атомов.
В спектрах ядерного магнитного резонанса гомотопные атомы и группы всегда характеризуются одним и тем же химическим сдвигом, в то время как диастереотопные различаются по величине химического сдвига. Энантиотопные атомы и группы имеют одинаковый химический сдвиг в ахиральных растворителях и разный в присутствии хиральных растворителей или комплексообразователей. Диастереотопные атомы и группы различаются по скоростям реакций с любыми реагентами, энантиотопные – по скоростям их реакций с хиральными реагентами (или с ахиральными в присутствии хиральных катализаторов).
Термины «диастереотопия», «энантиотопия» и «гомотопия» выражают отношение одной группы к другой и поэтому могут меняться в зависимости от выбора объекта для сравнения. Так, в циклобутаноне атомы HA гомотопны, и каждый имеет два типа энантиотопных отношений с атомами HB, которые также образуют гомотопный набор. Ни один из них не связан никакими операциями симметрии с гомотопной парой атомов HC, которые занимают другое структурное положение. В 3-метилциклобутаноне атомы HA и HB образуют два энантиотопных набора, тогда как любой атом HA диастереотопен по отношению к любому HB.
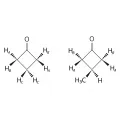 Структурные формулы циклобутанона и 3-метилциклобутанона.Топные отношения для групп можно распространить на отношения симметрии сторон.
Структурные формулы циклобутанона и 3-метилциклобутанона.Топные отношения для групп можно распространить на отношения симметрии сторон.
Гомотопными сторонами молекулы являются те, которые содержат копланарную ось симметрии. Такие стороны можно найти как в ахиральных молекулах, например ацетоне, изобутилене, так и в хиральных, например циклопентаноне.
Энантиотопными сторонами являются две стороны любой молекулярной плоскости, которая одновременно служит плоскостью симметрии молекулы, но не содержит копланарной оси симметрии. Энантиотопны стороны карбонильной группы в ацетальдегиде, фенилметилсульфиде.
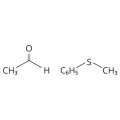 Структурные формулы ацетальдегида и фенилметилсульфида.Диастереотопными являются две стороны любой молекулярной плоскости, которая не служит плоскостью симметрии и не содержит копланарной оси симметрии. Так, стороны группы С=О в асимметричной молекуле 1-фенилэтилацетата диастереотопны. Плоскость симметрии, перпендикулярная рассматриваемой плоскости, допускает диастереотопность, как можно видеть на примере 3-метилциклобутанона, содержащего карбонильную группу с диастереотопными сторонами.
Структурные формулы ацетальдегида и фенилметилсульфида.Диастереотопными являются две стороны любой молекулярной плоскости, которая не служит плоскостью симметрии и не содержит копланарной оси симметрии. Так, стороны группы С=О в асимметричной молекуле 1-фенилэтилацетата диастереотопны. Плоскость симметрии, перпендикулярная рассматриваемой плоскости, допускает диастереотопность, как можно видеть на примере 3-метилциклобутанона, содержащего карбонильную группу с диастереотопными сторонами.
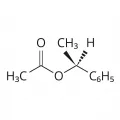 Структурная формула 1-фенилэтилацетата.
Структурная формула 1-фенилэтилацетата.
