Оксилипины
Оксилипи́ны, биологически активные соединения, продукты окисления полиненасыщенных жирных кислот (ПНЖК), протекающего с участием молекулярного кислорода. Распространены практически во всех царствах многоклеточных эукариот (у животных, растений, грибов, бактерий и разных групп водорослей) и активно задействованы в межклеточной сигнализации, включая реакции на стресс и инфекцию. Могут образовываться с помощью ферментов (моно- или диоксигеназ) или неферментативно – в результате реакции ПНЖК с молекулярным кислородом, однако основные биологические функции выполняют оксилипины, синтезируемые с помощью ферментов.
Основные группы оксилипинов
Основные группы оксилипинов | Путь синтеза | Функции | Таксономические группы |
Циклооксигеназный | Стимуляция воспаления, усиление ощущения боли, сокращение и регуляция тонуса гладких мышц | ||
Липоксигеназный | Стимуляция воспаления, регуляция чувства боли и тонуса гладких мышц | Позвоночные | |
Липоксины | Липоксигеназный | Противовоспалительный эффект | Позвоночные |
Липоксигеназный | Реакция на стресс, повреждение, инфекцию | ||
Дивиниловые эфиры | Липоксигеназный | Бактерицидная и фунгицидная функция | Растения |
Изопростаны | Неферментативный | Маркеры и медиаторы оксидативного стресса | Позвоночные |
Фитопростаны | Неферментативный | Маркеры и медиаторы оксидативного стресса | Растения |
Ферментативно синтезируемые оксилипины
У позвоночных и человека
Оксилипины позвоночных и человека образуются по трём основным метаболическим путям (липоксигеназному, циклооксигеназному и пути с участием цитохрома P450) из 20-углеродных ПНЖК (чаще всего из арахидоновой кислоты), поэтому называются эйкозаноидами (от греч. εικοσι – двадцать).
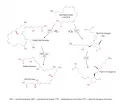 Упрощённая схема биосинтеза эйкозаноидов у млекопитающих и человека.Липоксигеназный путь начинается с окисления ПНЖК ферментом липоксигеназой, формирующим ациклические гидропероксиды, которые впоследствии могут трансформироваться в различные соединения. Ферменты лейкотриен-синтазы преобразуют их в лейкоториены – вещества, стимулирующие воспаление, повышающие болевую чувствительность и вызывающие сокращение гладкой мускулатуры. Гиперпродукция лейкотриенов в тканях бронхов – важное звено патогенеза бронхиальной астмы.
Упрощённая схема биосинтеза эйкозаноидов у млекопитающих и человека.Липоксигеназный путь начинается с окисления ПНЖК ферментом липоксигеназой, формирующим ациклические гидропероксиды, которые впоследствии могут трансформироваться в различные соединения. Ферменты лейкотриен-синтазы преобразуют их в лейкоториены – вещества, стимулирующие воспаление, повышающие болевую чувствительность и вызывающие сокращение гладкой мускулатуры. Гиперпродукция лейкотриенов в тканях бронхов – важное звено патогенеза бронхиальной астмы.
Циклооксигеназный путь начинается с окисления ПНЖК ферментом циклооксигеназой, формирующим циклические эндопероксиды, которые затем преобразуются соответствующими ферментами в простагландины и тромбоксаны. Это важные медиаторы боли, свёртывания крови, регуляции сосудистого тонуса и родовой деятельности. В человеческом организме как простагландины, так и лейкотриены действуют через рецепторы, сопряжённые с G-белком (Куракин. 2020; 2021).
Поскольку основная функция простагландинов, тромбоксанов и лейкотриенов – первоначальный ответ тканей на повреждение (запуск воспаления, создание ощущения боли и регуляция свёртывания крови), ферменты биосинтеза этих оксилипинов или распознающие их рецепторы – популярные мишени для лекарственных препаратов.
Помимо эйкозаноидов с провоспалительным действием, у человека вырабатываются противовоспалительные эйкозаноиды – медиаторы разрешения воспаления (pro-resolving mediators): липоксины (Chandrasekharan. 2015), маресины (Maresins ... 2018), резольвины и протектины (Kohli. 2009). Их относят к неклассическим эйкозаноидам, вместе с эпоксиэйкозатриеновыми кислотами они образуются по пути с участием цитохрома P450. Последние играют важную роль в ангиогенезе и защите тканей от ишемии (Spector. 2015).
У растений
В отличие от человека, растения для синтеза оксилипинов используют линоленовую кислоту. Однако пути их биосинтеза и биологические функции сходны. В синтезе оксилипинов растений участвуют липоксигеназы, гомологичные липоксигеназам животных. По липоксигеназному пути у растений синтезируются жасмонаты – мощные фитогормоны, регулирующие ответ растений на различные стрессы и повреждения (в том числе внедрение патогена). Химически жасмонаты сходны с простагландинами животных. Кроме липоксигеназы, в синтезе жасмонатов участвуют ферменты алленоксидсинтаза и алленоксидциклаза.
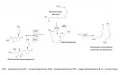 Упрощённая схема биосинтеза оксилипинов у растений.Помимо преобразования в алленоксид и циклизации, у растений гидропероксиды ПНЖК (образованные под действием липоксигеназы) могут также расщепляться гидропероксидлиазой с образованием летучих альдегидов и спиртов, в том числе гексенолов и гексеналей (Хелдт. 2011).
Упрощённая схема биосинтеза оксилипинов у растений.Помимо преобразования в алленоксид и циклизации, у растений гидропероксиды ПНЖК (образованные под действием липоксигеназы) могут также расщепляться гидропероксидлиазой с образованием летучих альдегидов и спиртов, в том числе гексенолов и гексеналей (Хелдт. 2011).
Коренное отличие метаболизма оксилипинов растений и человека в том, что все человеческие оксилипины нелетучи. Даже у жасмонатов есть летучая форма – метиловый эфир жасмоновой кислоты, или метилжасмонат, может передаваться по воздуху от растения к растению, инициируя защитные реакции заблаговременно (Volatile methyl jasmonate ... 2014). Сигнальная функция оксилипинов растений позволяет им «предупреждать» сородичей об опасности, несмотря на отсутствие звуковой коммуникации (как у животных). Летучие оксилипины растений выполняют прямые бактерицидные, а также сигнальные функции. Вышеперечисленными веществами спектр оксилипинов растений не ограничивается – они также способны синтезировать фунгицидные дивиниловые эфиры, травматин и некоторые другие оксилипины (Хелдт. 2011).
У растений отсутствует воспалительная реакция, однако растительные оксилипины также регулируют стереотипную реакцию защиты от патогенов, в основном через активацию синтеза фитоалексинов. Помимо этого, они запускают синтез разнообразных токсинов и ингибиторов пищеварительных ферментов, призванных противодействовать растительноядным животным. Именно животные чаще всего становятся причиной повреждения ткани растений, поэтому неудивительно, что оксилипиновый «иммунитет» растений распространяется и на патогенные микроорганизмы, и на животных, в отличие от своего человеческого аналога (Куракин. 2021).
Комплексная стратегия защиты растений от растительноядных животных выходит за рамки конкретной особи и даже конкретного вида. Так, летучие оксилипины привлекают наездников (паразитоидных ос) – естественных врагов гусениц, поедающих растения (Хелдт. 2011).
У водорослей
Водоросли различных таксономических групп также реагируют на инфекцию, стресс или повреждение выделением оксилипинов и используют их для иммунной защиты. Кроме того, бурые и диатомовые водоросли синтезируют необычные соединения, выполняющие роль феромонов – сигнальных веществ, благодаря которым мужские и женские половые клетки находят друг друга. По структуре эти молекулы представляют собой разветвлённые или циклические углеводороды; существуют убедительные доказательства, что формируются они из оксилипинов. Предполагается, что в биосинтезе участвуют липоксигеназы и гидропероксидлиазы, следовательно, этот процесс аналогичен биосинтезу летучих оксилипинов и спиртов у растений (Rui. 2010; Куракин. 2021).
У грибов
В биосинтезе оксилипинов у грибов принимают участие липоксигеназы. Если у большинства таксонов липоксигеназы содержат в качестве кофактора ион железа, то у грибов встречаются марганцевые липоксигеназы, которые вместо железа содержат марганец. При этом механизм катализа остаётся сходным (Brodhun. 2011). Оксилипины грибов, образующиеся по липоксигеназному пути, обеспечивают грибам чувство кворума, позволяющее менять свою морфологию в зависимости от плотности популяции (Brodhun. 2011; Morphological transitions ... 2008).
У грибов также есть гомологи циклооксигеназ, однако они не синтезируют циклические эндопероксиды, как у животных и человека. С биохимической точки зрения они относятся либо к липоксигеназам, либо к диолсинтазам (присоединяют к молекуле ПНЖК сразу две гидроксильные группы). Они участвуют в синтезе оксилипинов, регулирующих переключение между половым и бесполым размножением (Brodhun. 2011).
У простейших и бактерий
Предполагается, что наличие липоксигеназ (следовательно, способности синтезировать оксилипины) у бактерий и простейших связано с примитивной многоклеточностью и патогенностью для широкого круга хозяев, в том числе растений и позвоночных (Куракин. 2020; Куракин. 2021).
Экспериментальное подтверждение роли липоксигеназы как фактора патогенности бактерий на сегодняшний день получено для синегнойной палочки (Pseudomonas aeruginosa). Её липоксигеназа окисляет жирные кислоты хозяина до предшественников липоксинов и других противовоспалительных оксилипинов. Это подавляет воспалительную реакцию и облегчает синегнойной палочке проникновение в ткани (Pseudomonas aeruginosa lipoxygenase LoxA contributes ... 2019). Возможно, некоторые другие бактерии используют похожий механизм как для инфицирования человеческого организма, так и для проникновения в организм растений (Куракин. 2020; Куракин. 2021).
Неферментативно синтезируемые оксилипины
У ферментативно синтезируемых оксилипинов есть аналоги со сходной биологической активностью, которые синтезируются без участия ферментов за счёт реакций перекисного окисления липидов. Например, человеческим простагландинам соответствуют изопростаны, а жасмонатам растений – фитопростаны. Такие оксилипины – продукты и медиаторы оксидативного повреждения, поэтому используются в качестве маркеров оксидативного стресса как у животных, так и у растений (Montuschi. 2004, Phytoprostanes and phytofurans-oxidative stress ... 2020).
