Биолюминесцентные системы на основе целентеразина
Биолюминесце́нтные систе́мы на осно́ве целентерази́на, набор белков, небольших органических молекул и в ряде случаев ионов двухвалентных металлов, позволяющих некоторым видам морских организмов испускать свет. Ключевые компоненты: единый для всех люциферин (целентеразин) и различающиеся по структуре люциферазы. Ряд систем также может содержать целентеразинсвязывающий белок и различные флуоресцентные белки. Все известные целентеразинзависимые люциферазы являются монооксигеназами и катализируют одну и ту же реакцию окисления целентеразина кислородом. В некоторых случаях целентеразин является функциональной группой и объединён с ферментом, катализирующим его окисление, в единый фермент-субстратный комплекс – фотобелок. Биолюминесцентные системы на основе целентеразина хорошо изучены и нашли широкое применение в биотехнологии и медицинских исследованиях.
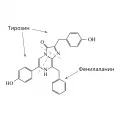
Целентеразин
Целентеразин выступает в качестве люциферина или функциональной группы фотобелков в биолюминесцентных системах самых разнообразных светящихся существ и содержится в тканях морских организмов, таксономически относящихся к 6 различным типам: стрекающих (Cnidaria), гребневиков (Ctenophora), моллюсков (Mollusca), членистоногих (Arthropoda), хордовых (Chordata) и щетинкочелюстных (Chaetognathа). Самые изученные – целентеразинзависимые биолюминесцентные системы кораллов рода Renilla, креветок семейства Oplophoridae и веслоногих ракообразных подкласса Copepoda.
В сравнительно небольших количествах целентеразин обнаружен в тканях некоторых несветящихся морских рыб и креветок. Поскольку путь биосинтеза целентеразина неизвестен, то вопрос о получении этого вещества использующими его живыми организмами в большинстве случаев остаётся открытым. Однако его наличие у различных несветящихся животных позволяет предположить, что некоторые из них могут получать целентеразин из пищи либо как единственный источник этого вещества, либо как добавку к целентеразину, синтезируемому в организме.
Подавляющее большинство известных видов биолюминесцентных организмов обитают в море, и большинство из изученных биолюминесцентных систем этих организмов используют в качестве субстрата целентеразин. К ним относятся группы мягких кораллов, веслоногих ракообразных, ракушковых ракообразных, головоногих моллюсков, сцифоидных медуз, десятиногих ракообразных и др.
Химическая формула целентеразина C26H21O3N3. Молекула имеет в своей основе 3 аминокислотных остатка: фенилаланин и два тирозина. В чистом виде вещество представляет собой кристаллы жёлтого цвета. В силу большой склонности к окислению кислородом целентеразин крайне нестабилен, особенно в водных растворах.
Люциферазы
Несмотря на то что столь таксономически удалённые друг от друга группы живых организмов используют одну и ту же молекулу в качестве субстрата в своих биолюминесцентных системах, клонированные из них люциферазы показали очень низкую степень гомологии между собой, что говорит о независимых путях возникновения и развития этих биолюминесцентных систем. 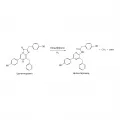 Схема биолюминесцентной реакции с участием целентеразина.В то же время все известные на данный момент целентеразинзависимые люциферазы являются монооксигеназами и катализируют одну и ту же реакцию окисления целентеразина кислородом. Их можно разделить на две группы: истинные люциферазы, катализирующие типичную реакцию окисления люциферина кислородом, и фотопротеины – биолюминесцентные белки, представляющие собой стабильные фермент-субстратные комплексы.
Схема биолюминесцентной реакции с участием целентеразина.В то же время все известные на данный момент целентеразинзависимые люциферазы являются монооксигеназами и катализируют одну и ту же реакцию окисления целентеразина кислородом. Их можно разделить на две группы: истинные люциферазы, катализирующие типичную реакцию окисления люциферина кислородом, и фотопротеины – биолюминесцентные белки, представляющие собой стабильные фермент-субстратные комплексы.
Биолюминесцентная система кораллов Renilla
Кораллы рода Renilla, также известные как морские анютины глазки (англ. sea pansy), принадлежат к подклассу восьмилучевых кораллов (Octocorallia) класса коралловые полипы (Anthozoa) и способны испускать свет в ответ на раздражение.  Коралл Renilla reniformis (морские анютины глазки).
Экспонат из коллекции Национального музея естественной истории (Вашингтон, США). Смитсоновский институт.Наиболее известный представитель Renilla reniformis обитает в тёплых водах континентального шельфа Западного полушария.
Коралл Renilla reniformis (морские анютины глазки).
Экспонат из коллекции Национального музея естественной истории (Вашингтон, США). Смитсоновский институт.Наиболее известный представитель Renilla reniformis обитает в тёплых водах континентального шельфа Западного полушария.
В коралловом полипе биолюминесцентная система локализована в специальных клетках – фотоцитах, а биолюминесценция контролируется нервной системой (Cormier. 1978). Биолюминесцентная система Renilla включает в себя люциферазу, целентеразин, целентеразинсвязывающий белок (coelenterazine-binding protein, CBP) и зелёный флуоресцентный белок (green fluorescent protein, GFP) (Charbonneau. 1979; Ward. 1979). CBP защищает нековалентно связанный с ним целентеразин от неспецифического окисления кислородом (Stepanyuk. 2008) и позволяет контролировать время и яркость свечения животного. Регуляция доступности связанного с CBP целентеразина осуществляется с помощью ионов кальция. Присутствие в системе GFP позволяет сместить максимум люминесценции в более длинноволновую область спектра (с длины волны λmax = 480 нм до λmax = 509 нм) благодаря механизму ферстеровского резонансного переноса энергии (Förster resonance energy transfer, FRET).
Люцифераза коралла Renilla reniformis (Renilla-luciferin 2-monooxygenase, Renilla luciferase, RLuc) клонирована в 1991 г. (Lorenz. 1991). Это белок с молекулярной массой 36 кДа, обладающий внутриклеточной локализацией. Температурный оптимум работы люциферазы RLuc 18–37 °C, рН-оптимум лежит в диапазоне 6–7, однако квантовый выход реакции довольно низкий (Matthews. 1977).
Эксперименты показали, что RLuc in vitro способна окислять целентеразин с испусканием квантов света и без дополнительных белков. Однако присутствие GFP как in vitro, так и in vivo увеличивает квантовый выход реакции, а максимум люминесценции смещается с длины волны λmax = 480 нм до λmax = 509 нм благодаря FRET (Ward. 1979). Эффективность люминесцентной реакции ощутимо возрастала, если вместо целентеразина к люциферазе добавляли CBP (Coelenterazine-binding protein ... 2008).
Несмотря на монооксигеназную природу RLuc, показано её родство с белками семейства α/β гидролаз (Consensus guided mutagenesis ... 2006), что также подтверждается сходством пространственной структуры этих ферментов, которое гораздо выше, чем с другими целентеразинзависимыми люциферазами и фотобелками (All three Ca2+-binding loops ... 2005; Spatial structure ... 2013).
Люцифераза Renilla и инструменты анализа, созданные на её основе, широко используются в науке и медицине: в исследованиях вирусных инфекций, изучении стволовых клеток, высокопроизводительном скрининге лекарственных препаратов, изучении рака. Однако наиболее активно биолюминесцентные методы исследований на основе люциферазы Renilla создавались для биоимиджинга и исследований белок-белковых взаимодействий.
Биолюминесцентная система креветок семейства Oplophoridae
Креветки Oplophorus gracilirostris относятся к отряду десятиногие ракообразные (Decapoda) класса высшие раки (Malacostraca). Эти глубоководные креветки способны в ответ на стимуляцию производить светящуюся слизь с помощью секреторных органов в основании антенн и ног, также на ногах имеются фотофоры.  Креветка Oplophorus gracilirostris.Считается, что Oplophorus gracilirostris используют светящийся секрет для защиты от хищников.
Креветка Oplophorus gracilirostris.Считается, что Oplophorus gracilirostris используют светящийся секрет для защиты от хищников.
Молекулярная масса природной формы люциферазы Oplophorus gracilirostris – около 106 кДа (Secretional luciferase ... 2000). Белок является секретируемым, склонен к агрегации и потере активности в растворах с рН меньше 7, имеет максимум биолюминесценции 454 нм. Однако, по данным гель-электрофореза, этот белковый комплекс состоит из 4 субъединиц, 2 с массой 19 кДа и 2 с массой 35 кДа.
Последовательности этих белков клонированы в 2000 г. (Secretional luciferase ... 2000), но биолюминесцентная активность была показана только для субъединицы 19 кДа (Satoshi Inouye. 2007). Данные экспериментов косвенно указывают на то, что субъединица с массой 35 кДа несёт функцию стабилизации каталитической субъединицы в природной люциферазе (Satoshi Inouye. 2007). Яркость свечения биолюминесцентной реакции с участием люциферазы Oplophorus gracilirostris подвержена значительному влиянию температуры, концентрации солей в реакционной смеси и её рН. Температурный оптимум биолюминесцентной реакции около 40 °C, рН-оптимум – примерно 9.
Широкая субстратная специфичность люциферазы Oplophorus gracilirostris (Satoshi Inouye. 1997) позволяет подбирать химически модифицированные аналоги целентеразина для улучшения спектральных характеристик и яркости биолюминесцентной реакции. С помощью методов направленного и случайного мутагенеза из субъединицы с массой 19 кДа были получены сначала более стабильная форма этого белка, имеющего в 3 раза более высокую биолюминесцентную активность (Engineered luciferase reporter ... 2012), а затем уже из неё мутантная форма, названная NanoLuc (NLuc). Яркость свечения биолюминесцентной реакции NLuc в лизатах клеток НЕК293 с фуримазином, аналогом целентеразина, в 2,5 млн раз выше, чем у субъединицы дикого типа с массой 19 кДа при реакции с целентеразином в тех же условиях, и в 150 раз выше, чем у реакций светлячковой люциферазы и люциферазы Renilla в аналогичных условиях (Engineered luciferase reporter ... 2012).
Именно NLuc – мутантная форма люциферазы Oplophorus gracilirostris – нашла широчайшее применение в различных областях биологии и медицины. Малые размеры молекулы делают её незаменимой для исследований, в которых размер гена имеет критически важное значение, к примеру для исследований вирусов. Как и исходная люцифераза Oplophorus gracilirostris, NLuc является секретируемым белком, что в совокупности с яркостью делает её прекрасным инструментом для биоимиджинга и маркерным белком в составе химерных белков. Биолюминесцентные методы анализа, созданные на основе NLuc, используются для создания платформ высокопроизводительного скрининга лекарственных препаратов, в методах детекции опиоидов в крови и каннабиноидов в моче, в оптогенетических исследованиях.
Биолюминесцентная система веслоногих ракообразных подкласса Copepoda
Веслоногие ракообразные (копеподы, Copepoda) – один из крупнейших по числу видов подкласс ракообразных, его представители многочисленны и играют важную роль в морских пищевых цепях.  Копепод вида Metridia longa.Биолюминесцентные виды обнаружены в отрядах циклопы (Cyclopoida) и каланиды (Calanoida). К первому относится род Oncaea, а ко второму – множество родов способных к свечению животных, в том числе Metridia, Pleuromamma и Gaussia. Биолюминесцентные копеподы способны производить светящийся секрет с помощью желёз на конечностях или теле (Herring. 1978).
Копепод вида Metridia longa.Биолюминесцентные виды обнаружены в отрядах циклопы (Cyclopoida) и каланиды (Calanoida). К первому относится род Oncaea, а ко второму – множество родов способных к свечению животных, в том числе Metridia, Pleuromamma и Gaussia. Биолюминесцентные копеподы способны производить светящийся секрет с помощью желёз на конечностях или теле (Herring. 1978).
Первыми были клонированы люциферазы видов Gaussia princeps (Bryan. 1999) и M. longa (Markova. 2004) GpLuc и MLuc соответственно. Это небольшие, размером около 20 кДа, секретируемые белки. Они содержат сигнальный пептид, необходимый для секреции, вариабельный N-концевой домен и консервативный C-концевой домен. Согласно данным экспериментов, вариабельный домен не имеет отношения непосредственно к биолюминесцентной функции фермента (Markova. 2012). Однако отсутствие этого домена в рекомбинантном белке крайне негативно сказывается на кинетике люминесцентной реакции, что указывает на его стабилизирующую и/или регуляторную роль. Константный домен люцифераз копепод отвечает за биолюминесцентную функцию (Cloning and expression ... 2004 ; Satoshi Inouye. 2008).
Люциферазы копепод являются секретируемыми белками, склонны к агрегации, имеют высокую биолюминесцентную активность и термостабильность (Two forms of secreted ... 2008) – даже после кипячения в течение 1 ч одна из изоформ MLuc теряет всего 50 % своей активности (Markova. 2015). Люциферин-люциферазная реакция копепод имеет очень быструю кинетику (Markova. 2012).
Известны последовательности 28 люцифераз копепод, принадлежащих 12 различным видам, причём у некоторых видов копепод присутствует по нескольку генов, кодирующих 2–3 изоформы люциферазы.
Для решения различных проблем, возникающих при практическом применении люцифераз копепод, создано множество различных мутантных форм с улучшенными характеристиками: с пониженной кинетикой реакции (Directed molecular evolution ... 2013; Superluminescent variants ... 2011), со спектром биолюминесценции, сдвинутым в более длинноволновую область, и большей яркостью (Superluminescent variants ... 2011; Sung Bae Kim. 2014; 2013). Клонирована самая маленькая на данный момент природная люцифераза – изоформа MLuc массой 16,5 кДа (Markova. 2015).
Люциферазы копепод и созданные на их основе инструменты анализа нашли применение в биомедицинских исследованиях. Разработано множество приложений для исследования инфекционных заболеваний, в том числе вызванных вирусами ВИЧ, гриппа, гепатитов C и B, грибами Candida albicans, простейшими токсоплазмами (Toxoplasma gondii). Методики, основанные на биолюминесцентной системе копепод, используются для исследований рака, проведения иммуноанализов и в биоимиджинге.